Il fotocromismo consiste in una trasformazione reversibile di specie chimiche a seguito dell’assorbimento di una radiazione elettromagnetica tra due forme A e B che hanno diversi spettri di assorbimento pertanto si verificano variazioni di proprietà fisico-chimiche, come l’indice di rifrazione, la costante dielettrica, il potenziale di riduzione e la struttura geometrica.
Il fenomeno del fotocromismo fu scoperto per la prima volta alla fine degli anni ’70 dell’Ottocento. La capacità di cambiare colorazione sotto eccitazione della luce UV, detta fototropia, fu studiata per la prima volta nel 1899 dal chimico tedesco Willy Marckwald, quando pubblicò il suo lavoro riguardante il cambiamento di colore reversibile di un chetone della famiglia del naftalene.
Fu solo nel 1950 che il chimico israeliano Yehudah Hirshberg introdusse la parola “fotocromia”, che deriva dal greco φως che significa luce e χρώμα che significa colore che usò per descrivere la colorazione reversibile del diantrachinone C28H16O2 . Dagli anni ’70 il termine fotocromia fu abbandonato e sostituito dal termine fotocromismo, che nel campo dei minerali assume il nome di tenebrescenza. Da allora i meccanismi optoelettronici alla base del fotocromismo suscitano continuamente un notevole interesse scientifico.
Sistemi fotocromatici
I sistemi fotocromatici possono essere classificati in due categorie a seconda della stabilità termica della specie generata. Le due categorie di tali sistemi sono P, tipo fotochimicamente reversibile e T tipo termicamente reversibile sebbene la reversibilità della risposta è un aspetto chiave in entrambi i tipi di fotocromismo.
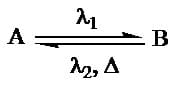
I sistemi di tipo P cambiano colore quando irradiati con uno specifico intervallo di lunghezze d’onda, quindi rimangono in questo stato dopo la rimozione dello stimolo. Solo quando vengono sottoposti a una luce di diversa lunghezza d’onda ritornano al loro colore originale
Al contrario, nei sistemi di tipo T il comportamento si manifesta se la luce è in grado di guidare il cambiamento in una sola direzione e tornano al loro stato originale quando non sono più esposti alla sorgente luminosa.
Fotocromismo nei composti inorganici
Negli ultimi decenni, i composti di ossido di tungsteno (WOx ) sono stati studiati per il loro fotocromismo e per la loro versatilità strutturale, che danno origine a promettenti potenziali applicazioni tra cui dispositivi ottici, sensori di gas, fotocatalizzatori, display a schermo piatto ed emissioni di campo.

L’ossido di tungsteno presenta un band gap corrispondente alla differenza di energia tra la banda di valenza, che è occupata dagli elettroni provenienti dagli orbitali 2p dell’ossigeno, e la banda di conduzione, che è formata principalmente da orbitali 5d vuoti del tungsteno. La banda di conduzione è costituita principalmente da orbitali t2g mentre gli orbitali eg si trovano a energie molto più elevate.
Poiché WO3 è un semiconduttore a banda proibita di tipo n, la sua transizione fotocromatica dal giallo al blu viene ottenuta sotto irradiazione UV con lunghezza d’onda inferiore a 370 nm.
Il triossido di molibdeno ortorombico uno dei composti più noto che presenta fotocromismo. È costituito da cristalli planari a doppio strato di ottaedri MoO6 distorti tenuti insieme in direzione verticale da deboli forze di van der Waals. Gli elettroni negli orbitali 2p dell’ossigeno possono essere eccitati in modo reversibile negli orbitali 4d del molibdeno, determinando il cambiamento del numero di ossidazione del molibdeno da Mo6+ a Mo5+ , che porta alla colorazione blu.
Il vanadio forma diversi ossidi, come VO2 , V2O3 e V2O5 che, in forma di film sottile, sono utilizzati come componenti in dispositivi ottici ed elettrici. In particolare, l’ossido di vanadio (V) V2O5 è stato ampiamente studiato come semiconduttore di tipo n ad ampia banda proibita per quanto riguarda le sue proprietà fotocromatiche.
Esso, in forma policristallina, mostra caratteristiche di fotocromismo in luce visibile. L’ossido di vanadio (V) diventa blu-nero dopo irradiazione con luce laser visibile con una lunghezza d’onda di 514.5 nm a causa della riduzione indotta dalla luce di V5+.
Fotocromismo nei composti organici
Vi sono molti esempi di composti organici che cambiano colore dopo irradiazione con la luce e ritornano al loro stato originale dopo la rimozione dello stimolo. Il fotocromismo di composti organici è in rapido sviluppo nel campo della fotochimica sebbene già dal 1952 si conosca che alcune molecole appartenenti alla classe degli spiropirani, mostrano proprietà fotocromiche.
Gli spiropirani, composti costituiti da un isomero 2H- pirano in cui l’atomo di idrogeno in posizione due è sostituito da un secondo sistema ad anello legato all’atomo di carbonio in posizione due di pirano e, quindi i due anelli, presentando un atomo di carbonio in comune appartengono alla classe dei composti bicilici di tipo spiranico.

Altri composti di interesse sono le spiroossazine e i derivati del benzopirano, composto organico eterociclico, strutturalmente formato da un anello benzenico e uno di pirano condensati, che subiscono fotodissociazione e isomerizzazione termica cis-trans.
Gli azocomposti, composti che hanno formula di struttura R-N=N-R’ presentano fotoisomerizzazione cis-trans. La ricerca ha rivelato una serie di sostanze fotocromatiche nei diarileteni sostanze che hanno gruppi funzionali aromatici legati a ciascuna estremità di un doppio legame carbonio-carbonio.
