Ossido di tungsteno
L’ossido di tungsteno o ossido di tungsteno (VI) è un ossido in cui il tungsteno ha numero di ossidazione +6 e formula WO3. Nel 1841 il chimico Robert Oxland ottenne per la prima volta il l’ossido di tungsteno, elemento isolato per la prima volta dai fratelli José Delhuyar e Fausto Delhuyar alla fine del XVIII secolo.
L’ossido di tungsteno si presenta in natura sotto forma di ossido idrato, e si trova in minerali come la tungstite in forma monoidrata WO3·H2O in cui cristallizza nel sistema rombico e classe di simmetria bipiramidale, la meymacite in cui è biidrato e in forma amorfa WO3· 2 H2O e l’idrotungstite.
L’ossido di tungsteno è un semiconduttore con ampio band gap, eccellente conduttività ed elevata mobilità degli elettroni ed è considerato un materiale candidato per l’applicazione nell’optoelettronica, fotocatalizzatori elettrochimici e sensori di gas.
Queste applicazioni hanno rappresentato un’enorme forza trainante nel campo della ricerca e dell’ingegneria dei materiali a base di ossido di tungsteno e, in particolare, materiali mesostrutturati e materiali mesoporosi al fine di migliorarne le proprietà funzionali.
Struttura dell’ossido di tungsteno
La struttura cristallina dell’ossido di tungsteno è polimorfica e dipende dalla temperatura. È tetragonale a temperature superiori a 740 °C, ortorombico da 330 a 740 °C, monoclino da 17 a 330 °C e triclino da -50 a 17 °C e pertanto la struttura più diffusa e monoclina.
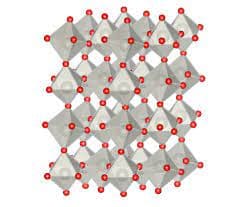
L’ossido di tungsteno mostra una struttura cubica simile a quella della perovskite ABO3 in cui non è presente A basata sulla condivisione degli angoli di ottaedri regolari con gli atomi di ossigeno all’angolo e gli atomi di tungsteno al centro di ciascun ottaedro.
La struttura cristallina, in cui la cella unitaria è costituita da 16 atomi presenta una disposizione alternata di piani contenenti rispettivamente O e WO2 perpendicolari alla direzione cristallografica principale.
Sintesi
In laboratorio può essere preparato per calcinazione del paratungstato di ammonio in condizioni ossidanti secondo la reazione:
(NH4)10[H2W12O42] · 4 H2O → 12 WO3 + 10 NH3 + 10 H2O
In laboratorio può essere ottenuto tramite sintesi idrotermale utilizzando, come precursore, una soluzione di tungstato di sodio Na2WO4 a cui viene aggiunto, quale acidificante, acido cloridrico e mantenendo una temperatura di 130-200°C per 1-5 giorni.
L’ossido di tungsteno può essere sintetizzato da reazioni di precipitazione utilizzando, ad esempio, una soluzione contenente carburo di tungsteno e tetracloruro di titanio. Alla soluzione è aggiunta ammoniaca e un tensioattivo per formare l’idrossido di tungsteno (VI) che ha formula W(OH)6 e l’idrossido di titanio (IV) che ha formula Ti(OH)4, centrifugando e calcinando per ottenere triossido di tungsteno.
Un’altra via sintetica si avvale del metodo di reazione gas-liquido in cui un gas viene introdotto in una soluzione salina per ottenere un precipitato precursore che viene poi essiccato per formare una polvere ultrafine. Si può utilizzare il tungstato di sodio che viene solubilizzato in una soluzione di etanolo e acqua distillata.
In tale soluzione viene introdotto cloruro di idrogeno con formazione di una sospensione che è lasciata riposare e successivamente centrifugata, lavata, essiccata e quindi macinata per ottenere polvere di ossido di tungsteno con distribuzione granulometrica uniforme con una dimensione media delle particelle inferiore a 100 nm.
Reazioni
L’ossido di tungsteno può essere facilmente ridotto in polvere metallica di tungsteno dall’idrogeno e dal monossido di carbonio utilizzato quale agente riducente. La reazione avviene alla temperatura di circa 750°C:
WO3 + 3 CO → W + 3 CO2
Altre reazioni di riduzione dell’ossido di tungsteno da cui si ottiene il metallo possono essere condotte anche in presenza di carbonio o di idrogeno gassoso:
2 WO3 + 3 C → 2 W + 3 CO2
WO3 + 3 H2 → W + 3 H2O
Applicazioni
L’ossido di tungsteno nanostrutturato ha un’elevata area superficiale specifica e una buona permeabilità superficiale, che lo rendono ideale per un’ampia gamma di applicazioni come sensori di gas, dispositivi di memoria, fotorivelatori e diodi ad alta temperatura.
Un fotorilevatore è un dispositivo capace di rivelare la radiazione elettromagnetica, fornendo in uscita un segnale avente un’intensità di corrente o una differenza di potenziale proporzionale all’intensità della radiazione rilevata.
Le prestazioni dei fotorivelatori dipendono solitamente dalla banda proibita dei semiconduttori e degli ossidi metallici. L’ossido di tungsteno è un tipico semiconduttore ad ampio band gap che risuona con l’energia della luce ultravioletta incidente, che può generare elettroni in eccesso che contribuiscono alla fotocorrente, migliorando così le caratteristiche del fotorivelatore.
Queste proprietà fisiche mostrano che i semiconduttori di ossido di tungsteno hanno un grande potenziale per la fabbricazione di rivelatori di luce visibile e UV ad alte prestazioni.
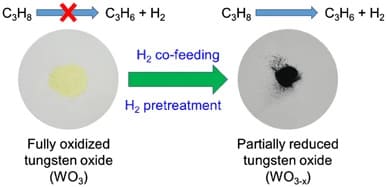
Notevoli sono i progressi nello sviluppo di elettrodi a base di ossido di tungsteno per applicazioni di accumulo di energia, principalmente supercondensatori e batterie. Il tungsteno si trova in vari ossidi stechiometrici e non stechiometrici generalmente indicati come WO3-x
Gli ossidi non stechiometrici hanno mostrato un’attività catalitica e una selettività superiori rispetto all’ossido di cromo (III) e all’ossido di gallio nella deidrogenazione del propano in propene che è una delle reazioni importanti per il suo elevato valore aggiunto.
Compositi
Gli attuali progressi nello sviluppo dei dispositivi di stoccaggio dell’energia rappresentano il fattore più importante che consentirà alla comunità scientifica di sviluppare risorse per soddisfare la domanda energetica globale del 21° secolo.
I materiali nanostrutturati possono essere utilizzati come elettrodi efficaci per dispositivi di accumulo di energia perché offrono varie caratteristiche promettenti, tra cui elevati rapporti superficie-volume, eccezionali caratteristiche di trasporto di carica e buone proprietà fisico-chimiche.
Fino ad ora, i pionieri in questo campo di ricerca si sono concentrati sulla preparazione di materiali per elettrodi positivi per applicazioni di accumulo di energia, tuttavia, le prestazioni elettrochimiche degli elettrodi negativi sono riportate meno frequentemente.
Tra i diversi materiali a base di ossido di tungsteno, il triossido di tungsteno è stato studiato come materiale per elettrodi per diverse applicazioni grazie alle sue eccellenti caratteristiche di trasporto di carica, proprietà fisico-chimiche uniche e buona resistenza alla corrosione.
Vari compositi a base di ossido di tungsteno, come WO3 /carbonio, WO3 /polimeri, WO3 /ossidi metallici e ossidi metallici binari a base di tungsteno, sono stati utilizzati per applicazioni in supercondensatori e batterie. I compositi WO3 /carbonio, sono stati spesso utilizzati per la loro interessante conduttività e il basso costo.
Oltre ai compositi con il carbonio e con gli ossidi di metalli di transizione, anche i materiali organici, in particolare i polimeri conduttivi, sono utilizzati per la loro alta conduttività, basso costo e facile fabbricazione.



