Acetato di etile: proprietà, sintesi, reazioni
L’acetato di etile è un estere con formula CH3COOCH2CH3 che si presenta come un liquido incolore dall’odore di frutta. Fu ottenuto per la prima volta dal chimico francese Louis-Léon de Brancas nel 1759 per distillazione di una miscela di etanolo e acido acetico
Proprietà dell’acetato di etile
L’acetato di etile è scarsamente solubile in acqua ma è solubile in molti solventi organici come benzene, acetone, etanolo, etere etilico e cloroformio.
L’acetato di etile è un ottimo solvente per la nitrocellulosa, gomma clorinata, plastificanti, grassi, oli, cere, alcune resine sia naturali che sintetiche come polivilacetato, poliacrilato, polistirene e resine alchidiche. Una miscela di acetato di etile e etanolo al 20% è un buon solvente per l’acetato di cellulosa.
Sintesi
L’acetato di etile può essere ottenuto su scala industriale attraverso varie vie sintetiche:
Questo metodo è il più diffuso e prevede la reazione tra etanolo e acido acetico in presenza di un acido, come acido solforico o acido cloridrico, come catalizzatore:
CH3CH2OH + CH3COOH → CH3COOCH2CH3 + H2O
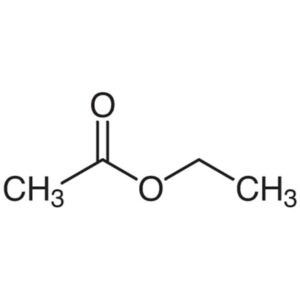
Il metodo presenta tuttavia alcuni svantaggi dovuti alla cinetica della reazione e alla resa non molto elevata che può essere aumentata allontanando acqua durante la reazione e, secondo il Principio di Le Chatelier, l’equilibrio si sposta verso destra. Inoltre, a causa della formazione di miscele azeotropiche è molto difficile estrarre i componenti puri.
- deidrogenazione dell’etanolo
Questo metodo è meno costoso rispetto all’esterificazione sebbene richieda un eccesso di etanolo per giungere a completezza. La reazione viene condotta a una temperatura tra 200 e 260 °C in presenza di rame o cromito di rame quale catalizzatore.
Nella reazione viene ottenuto idrogeno gassoso come sottoprodotto:
2 CH3CH2OH → CH3COOCH2CH3 + 2 H2
La presenza di idrogeno rende costosa la separazione dell’acetato di etile
- reazione di Tishchenko
La reazione avviene dalla combinazione di due molecole di acetaldeide in presenza di un alcossido metallico quale catalizzatore:
2 CH3CHO → CH3COOCH2CH3
Reazioni
L’acetato di etile dà le reazioni tipiche degli esteri come:
la reazione può avvenire:
- in ambiente acido con formazione di acido acetico e etanolo
CH3COOCH2CH3 + H2O → CH3COOH + CH3CH2OH
- in ambiente con formazione di ione acetato e etanolo. Dopo l’addizione di OH– e l’eliminazione del gruppo -OCH2CH3 si forma dapprima l’acido acetico che reagisce rapidamente con -OH– per trasformarsi in acetato
- ammonolisi
La reazione avviene in presenza di ammoniaca che agisce da nucleofilo nei confronti del gruppo carbonilico con ottenimento di acetammide e etanolo:
CH3COOCH2CH3 + NH3 → CH3CONH2 + CH3CH2OH
- Reazione con idrossido di sodio
Dalla reazione si ottengono acetato di sodio e etanolo:
CH3COOCH2CH3 + NaOH → CH3COONa + CH3CH2OH
- Reazione con bromuro di metilmagnesio
Dalla reazione dell’acetato di etile con un reattivo di Grignard come il bromuro di metilmagnesio si ottiene il 2-metil-2-propanolo (CH3)3COH noto anche come alcol t-butilico
Usi
L’acetato di etile è utilizzato come:
- solvente nella produzione di vernici, gomma, adesivi, fibre, detergenti
- solvente per allontanare la caffeina dai chicchi di caffè
- eluente nelle tecniche cromatografiche
- mezzo di estrazione nella concentrazione e purificazione degli antibiotici
- sostanza in grado di conferire aromi fruttati a caramelle, gomme masticanti e prodotti da forno
L’acetato di etile è utilizzato nelle vernici per automobili e macchinari, inchiostri, oli lubrificanti, creme idratanti, smalti per unghie, smalti e solventi, diluenti per vernici, salviette preumidificate, adesivi in resina e gomma e aromi artificiali.



