Idrolisi degli esteri in ambiente acido e basico, meccanismo
L’idrolisi degli esteri può avvenire in ambiente acido detta retro-Fisher o in ambiente basico ed è detta saponificazione.
Gli esteri sono composti organici aventi formula generale RCOOR’ derivanti dalla reazione tra un alcol o un fenolo con un acido carbossilico. Nelle tipiche reazioni degli esteri il gruppo –OR’ è sostituito da un altro gruppo come avviene per l’idrolisi che può essere catalizzata dagli acidi o dalle basi.
Nel caso di catalisi acida la reazione di idrolisi degli esteri non è altro che l’inverso della reazione di esterificazione di Fischer. Si ha la formazione di un acido carbossilico e un alcol. Questa reazione è reversibile e giunge alla completezza in eccesso di acqua per il Principio di Le Chatelier.
Meccanismo di idrolisi degli esteri
Nel primo stadio della reazione di idrolisi avviene la protonazione dell’ossigeno carbonilico con formazione di un intermedio stabilizzato per risonanza

Il carbonio subisce l’attacco nucleofilo dell’ossigeno dell’acqua con formazione di un intermedio tetraedrico in cui l’ossigeno dell’acqua ha una carica positiva.
L’idrogeno legato a tale ossigeno si lega al gruppo –OR’e pertanto la carica positiva si trasferisce a quest’ultimo ossigeno. Il gruppo R’O+H che è un buon gruppo uscente si allontana dall’intermedio come R’OH.
Un ossigeno viene deprotonato con formazione di un doppio legame C=O e in questo stadio si forma l’acido carbossilico.

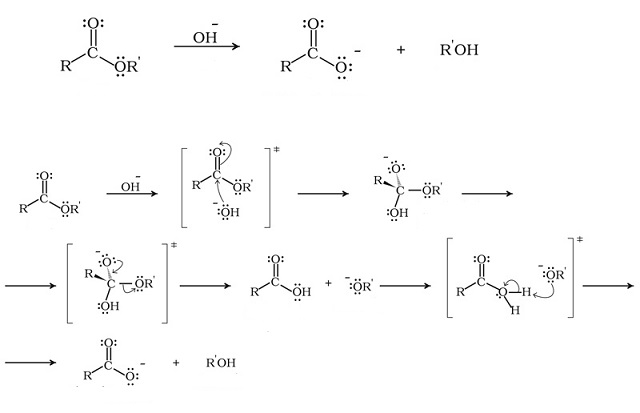
Saponificazione
Nel caso in cui l’estere sia trattato con una base si ha un’idrolisi basica con la formazione dello ione carbossilato e di un alcol e tale reazione è nota come saponificazione
Lo ione OH– conduce un attacco nucleofilo al carbonio carbonilico con formazione di un intermedio tetraedrico in cui l’ossigeno, a seguito della rottura del doppio legame con il carbonio ha carica negativa.
Il gruppo –OR’ è un buon gruppo uscente che si allontana dell’intermedio con formazione di un acido carbossilico. Lo ione alcossido estrae il protone dal gruppo –OH con formazione dello ione carbossilato e dell’alcol