Intermedi di reazione
Gli intermedi di reazione sono specie che sono altamente reattive, hanno un tempo di vita breve e vengono raramente isolati. La conoscenza del ruolo e della struttura degli intermedi di reazione nei processi chimici è fondamentale per comprendere i meccanismi di reazione costituiti da una sequenza di eventi che avvengono quando le molecole reagenti vengono convertite in prodotti. Gli intermedi di reazione più comuni sono carbocationi, carbanioni, radicali e carbeni.
Secondo la I.U.P.A.C. gli intermedi di reazione hanno una durata di vita maggiore a quella di una vibrazione molecolare, sono formati dai reagenti e reagiscono ulteriormente per dare i prodotti di reazione. Gli intermedi di reazione non devono essere confusi con lo stato di transizione in quanto l’intermedio ha una durata di vita discreta che sia pochi nanosecondi o molti giorni, mentre uno stato di transizione dura solo un ciclo di vibrazione del legame.
Gli intermedi di reazione si formano tipicamente nelle reazioni organiche ma possono presentarsi anche in una varietà di contesti biologici. Alcuni farmaci e molte sostanze fitochimiche che contengono, ad esempio, un anello tiofenico vengono ossidati dal citocromo P450 in intermedi reattivi, come i solfossidi, che possono legarsi covalentemente ai nucleofili tiolici nelle macromolecole, come le proteine.
Coordinata e intermedi di reazione
In un diagramma energetico gli intermedi di reazione hanno una energia minore rispetto allo stato di transizione che presentano un massimo di energia potenziale ed inoltre gli intermedi di reazione hanno una vita che dipende dalla profondità del minimo di energia. Si noti che questa definizione si applica solo a una reazione elementare mentre in una reazione multistadio sono presenti più stati di transizione.
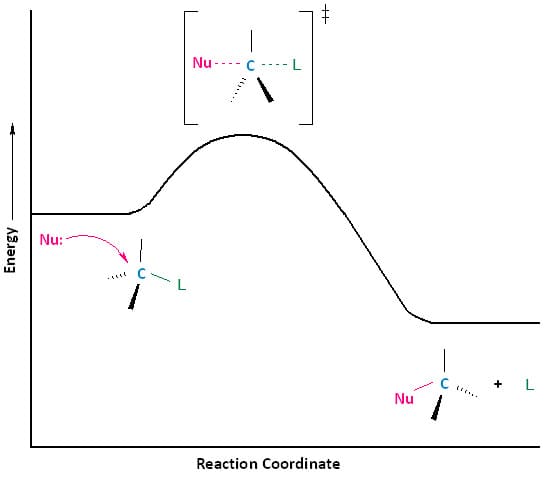
Inoltre vi sono reazioni che presentano uno stato di transizione ma non intermedi di reazione come, ad esempio, le reazioni che avvengono con un meccanismo concertato bimolecolare. Tali reazioni sono indicate con il simbolo SN2. Il simbolo Hughes–Ingold del meccanismo esprime due proprietà: SN sta per sostituzione nucleofila e il numero 2 indica che lo stadio che determina la velocità è bimolecolare .
In tali reazioni il carbonio legato al gruppo uscente ha una parziale carica positiva e viene attaccato del nucleofilo con formazione, nello stato di transizione, di un intermedio. In esso inizia a rompersi il legame tra il carbonio e il gruppo uscente e inizia a formarsi il legame tra nucleofilo e carbonio. La reazione avviene quindi in un unico stadio, con un solo stato di transizione e senza formazione di intermedi di reazione.

Le reazioni che hanno un meccanismo SN1 avvengono in due stadi. In esse si verifica un attacco di un nucleofilo a un atomo di carbonio a cui è legato un buon gruppo uscente formando un nuovo legame. Nel primo stadio che costituisce lo stadio lento si forma quindi il carbocatione e nel secondo stadio che costituisce lo stadio veloce vi è il rapido attacco del nucleofilo al carbocatione con formazione di un legame σ.
Il profilo della reazione mostra due stati di transizione e un intermedio di reazione. Il primo stato di transizione, quello a energia più alta, corrisponde alla parziale rottura del legame tra il carbonio e il gruppo uscente mentre il secondo stato di transizione corrisponde alla formazione del nuovo legame tra il carbonio e il nucleofilo
Carbocationi
I carbocationi sono intermedi di reazione che presentano geometria planare in cui il carbonio ha una carica positiva ed ha un’ibridazione sp2. Il carbocatione ha solo sei elettroni nel suo guscio di valenza esterno invece degli otto elettroni di valenza che garantiscono la massima stabilità come è stabilito dalla regola dell’ottetto.
Pertanto, i carbocationi sono spesso reattivi e cercano di riempire l’ottetto di elettroni di valenza e di riacquistare una carica neutra. Sono elettrofili altamente attivi che possono reagire con una varietà di nucleofili. L’intermedio carbocationico si forma nelle reazioni di sostituzione nucleofila unimolecolare, nelle reazioni di eliminazione unimolecolari, nelle reazioni di addizione elettrofila degli alcheni e nei riarrangiamenti che coinvolgono lo spostamento dell’idruro o lo spostamento degli alchili.
I carbocationi sono intermedi di reazione in cui al carbonio carico positivamente sono legati gruppi alchilici, gruppi arilici o idrogeno. A seconda del numero di gruppi legati al carbonio carico positivamente vi sono i carbocationi terziari in cui sono presenti tre gruppi stabilizzati per effetto induttivo.
Nei carbocationi secondari sono presenti due gruppi e un idrogeno, nei primari un gruppo e due idrogeni ed infine il carbocatione metilico CH3+ in cui sono presenti tre atomi di idrogeno. I carbocationi alchilici più stabili sono quelli più sostituiti, infatti l’ordine di stabilità di questo tipo di carbocationi è: terziario > secondario > primario >> metilico.
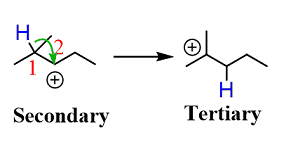
I carbocationi secondari frequentemente danno luogo a fenomeni di riarrangiamento. Il riarrangiamento è molto comune ed è uno tra i fattori a cui è imputabile la formazione di due o più prodotti da una reazione. Lo shift di un idrogeno o di un gruppo alchilico, generalmente un gruppo metilico, consente a un carbocatione secondario di trasformarsi in un carbocatione terziario che ha una maggiore stabilità.
Nelle reazioni di sostituzione nucleofila i carbocationi si formano a seguito di scissione eterolitica tra il carbonio e un buon gruppo uscente seguita dalla rimozione dello stesso. Un esempio di tali reazioni è costituito dalla reazione del bromuro di t-butile con acqua da cui si ottiene l’alcol t-butilico.
I carbocationi possono formarsi anche nelle reazioni di addizione elettrofila degli alcheni come, ad esempio, l’addizione di acidi alogenidrici e l’idratazione. Il meccanismo comune a tutte le reazioni di addizione elettrofila prevede l’attacco iniziale di un generico elettrofilo E+. Esso può essere sia carico positivamente che neutro e reagisce con l’alchene con formazione di un carbocatione
Carbanioni
I carbanioni sono specie reattive con struttura tetraedrica in cui la carica negativa è localizzata sull’atomo di carbonio che è ha ibridazione sp3. Tipicamente, i carbanioni si comportano come nucleofili e sono di natura basica. La nucleofilicità e la basicità del carbanione sono solitamente determinate dai gruppi sostituenti attaccati al carbonio caricato negativamente. Come nel caso della maggior parte delle specie di carbonio cariche, i gruppi sostituenti possono aumentare o diminuire la stabilità della specie.

La stabilità dei carbanioni è influenzata sia da fattori sterici sia elettronici e, come si è già visto per i carbocationi, tutti i fattori che disperdono la carica stabilizzano queste particelle reattive. La stabilità e la reattività dei carbanioni è determinata da alcuni fattori tra cui l’effetto induttivo per il quale gli atomi con elevata elettronegatività legati al carbanione ne stabilizzano la carica, mentre i gruppi donatori di elettroni la destabilizzano.
Un altro fattore è costituito dall’effetto di stabilizzazione per risonanza, attraverso il quale la delocalizzazione degli elettroni distribuisce la carica negativa su tutto il carbanione, aggiunge stabilità al processo. I sistemi aromatici aumentano la stabilità dei carbanioni quando sono presenti come gruppo sostituente e, come risultato dell’effetto di risonanza a causa della maggiore estensione della delocalizzazione degli elettroni sul sistema aromatico.



