Stato di transizione: equazione di Arrhenius, grafici
La velocità di una reazione è determinata dalla formazione di uno stato di transizione che soddisfa i requisiti di una collisione efficace. Lo stato di transizione è un aggregato molecolare in cui le molecole reagenti con sufficiente energia hanno dato luogo a un urto efficace a seguito del quale si trovano nelle condizioni di dare i prodotti di reazione.
La variazione dell’energia di attivazione richiesta per dare lo stato di transizione a partire dai reagenti è in relazione con la facilità con cui la reazione ha luogo.
Equazione di Arrhenius
La dipendenza della velocità della reazione dalla temperatura viene formulata dall’equazione di Arrhenius :
K = A e-Ea/RT
Dove K è la costante specifica della reazione; A la costante caratteristica della reazione detta fattore di frequenza; Ea l’energia di attivazione; R costante universale dei gas; T temperatura assoluta.
Se esprimiamo la suddetta equazione in forma logaritmica si ha:
ln K = ln A – Ea/RT
consideriamo due temperature T1 e T2 cui corrispondono due costanti di velocità K1 e K2; sostituendo tali valori si ha :
ln K1= ln A – Ea/RT1 ( 1
ln K2= ln A – Ea/RT2 (2
sottraiamo la (2 dalla (1 :
ln K1 – ln K2= – Ea/RT1 + Ea/RT2 = Ea/R ( 1/T2 – 1 /T1)
ovvero :
ln K1/K2= Ea/R ( 1 /T2 – 1/T1)
che può essere espressa anche come:
ln K2/K1= Ea/R( 1/T1 – 1/T2)
l’equazione di Arrhenius predice che un aumento della temperatura T produce un aumento della velocità di reazione a parità di Ea e di concentrazioni.
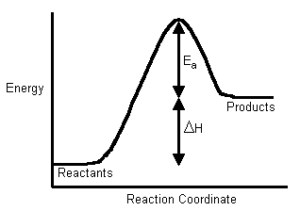
Le variazioni di energia nel corso di una reazione sono illustrate mediante un diagramma in cui si riporta l’energia in funzione di una coordinata che rappresenta il progredire di una reazione ed è detta coordinata di reazione. Quest’ultima rappresenta la continua modificazione della geometria del sistema mano a mano che la collisione schiaccia le molecole l’una contro l’altra, comprimendo, estendendo, modificando i legami ovvero rompendo legami preesistenti e formandone di nuovi.
A sinistra del diagramma sono indicate le molecole separate e non interagenti;

Reazioni a due stadi
Alcune reazioni procedono a due stadi e possono essere illustrate dal seguente diagramma:
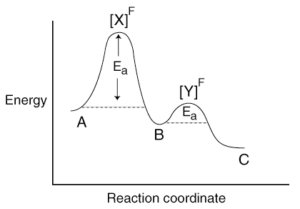 Ciascuno dei due stadi comporta uno stato di transizione, ma la velocità della reazione è determinata da quello definito stadio lento che corrisponde al punto più alto della curva. Il fatto che si formi un ulteriore intermedio, prima dei prodotti finali, non ha alcun effetto sulla velocità di reazione, poiché l’intermedio si decompone così rapidamente come esso si forma.
Ciascuno dei due stadi comporta uno stato di transizione, ma la velocità della reazione è determinata da quello definito stadio lento che corrisponde al punto più alto della curva. Il fatto che si formi un ulteriore intermedio, prima dei prodotti finali, non ha alcun effetto sulla velocità di reazione, poiché l’intermedio si decompone così rapidamente come esso si forma.
Le reazioni chimiche possono essere sia esotermiche (avvengono con sviluppo di energia) che endotermiche (avvengono con assorbimento di energia). Nelle reazioni esotermiche i prodotti di reazione hanno energia minore dei reagenti e il diagramma si presenta nelle forme viste. Se i prodotti hanno energia maggiore dei reagenti la reazione è endotermica