Elettrocatalisi
L’elettrocatalisi è un processo catalitico che coinvolge reazioni di ossidoriduzione attraverso il trasferimento diretto di elettroni. Sebbene il termine elettrocatalisi sia apparso in letteratura solo nel 1936 grazie a N. Kobosev, W. Monblanova che scoprirono che il catodo durante la reazione elettrochimica di formazione dell’idrogeno funge da catalizzatore il chimico tedesco Fritz Foerster menzionò esplicitamente la catalisi già nel 1905, quando descrisse l’evoluzione catodica dell’idrogeno.
I progressi nell’elettrocatalisi negli ultimi decenni sono stati in gran parte legati allo sviluppo di dispositivi di conversione e stoccaggio dell’energia come celle a combustibile ed elettrolisi. Gli ultimi decenni hanno visto un aumento significativo dell’interesse verso le tecnologie elettrochimiche di conversione e stoccaggio dell’energia e, di conseguenza, verso l’elettrochimica e l’elettrocatalisi. Numerosi ricercatori stati attratti da questo settore con conseguenti progressi spettacolari nel campo dell’elettrocatalisi.
L’elettrocatalisi è di grande interesse per il futuro sviluppo di tecniche di energia pulita e sostenibile attraverso la conversione di molecole come acqua, ossigeno, azoto e biossido di carbonio in materie prime chimiche a valore aggiunto o combustibili come idrogeno, metano e ammoniaca.
Elettrocatalizzatori
In generale, l’elettrocatalisi avviene all’interfaccia degli elettrocatalizzatori, dove elettroni, ioni e molecole possono partecipare a reazioni su specifici siti attivi. Un elettrocatalizzatore è una superficie in cui l‘energia chimica viene convertita elettrochimicamente in energia elettrica nelle celle a combustibile. Per la selezione di un elettrocatalizzatore e l’adattamento delle sue caratteristiche, è necessario valutarne sia la stabilità che la selettività.
Gli elettrocatalizzatori, come i comuni catalizzatori, influenzano l’aspetto cinetico di una reazione aumentando la velocità delle reazioni elettrochimiche attraverso l’interazione con i reagenti per alterare i percorsi di reazione e ridurre l’energia di attivazione e che non vengono consumati nel processo di reazione.
I metalli di transizione del quarto, quinto e sesto periodo e, in particolare, Fe, Rh, Pd, Ir, Pt, Au e le loro leghe sono usati come elettrocatalizzatori efficienti e sono utilizzati nell’industria chimica, nell’industria petrolchimica e nella purificazione dei gas di scarico delle automobili e nelle celle a combustibile. Tali elettrocatalizzatori presentano, tuttavia, molteplici svantaggi, tra cui la bassa selettività, l’impatto ambientale negativo oltre che la scarsa durabilità in quanto possono ossidarsi.
Pertanto, la ricerca si sta indirizzando a sviluppare alternative a basso costo, stabili e cataliticamente attive per l’applicazione nell’energia rinnovabile. I catalizzatori realizzati a base di carbonio presentano vantaggi quali elevata abbondanza di terra, basso costo, elevata conduttività elettrica, buona selettività e stabilità solida in condizioni sia acide che alcaline.
Reazioni nell’elettrocatalisi
Le principali reazioni coinvolte nell’elettrocatalisi sono la reazione di riduzione dell’ossigeno (ORR), la reazione di evoluzione dell’ossigeno (OER), la reazione di evoluzione dell’idrogeno (HER) e la reazione di riduzione della CO2 (CO2 RR), che richiedono tutte catalizzatori. Lo sviluppo di elettrocatalizzatori economici, privi di metalli nobili, efficienti, stabili e bifunzionali ha attirato un notevole interesse nella ricerca sull’elettrocatalisi e sui dispositivi di accumulo di energia basati su batterie ad aria.
Reazione di riduzione dell’ossigeno
Le condizioni di reazione di riduzione dell’ossigeno (ORR) per celle a combustibile con membrana a scambio protonico (PEMFC) hanno registrato un netto progresso grazie all’elettrocatalisi. Le celle a combustibile e le batterie metallo-aria sono dispositivi che convertono l’energia chimica in elettricità da un combustibile o un metallo tramite una reazione elettrochimica con l’ossigeno o altri agenti ossidanti.
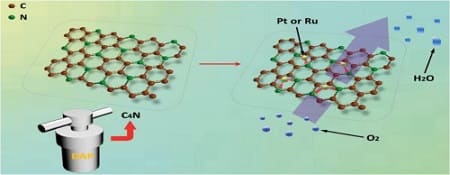
Le celle a combustibile con membrana a scambio protonico hanno attirato l’attenzione dei ricercatori grazie all’elevata densità di energia, alla efficienza di conversione dell’energia, alle emissioni inquinanti da basse a zero e all’elevata affidabilità, costituiscono una valida prospettiva per la fornitura di energia pulita e sostenibile per applicazioni residenziali, veicoli e sistemi di alimentazione stazionari.
Inoltre, le batterie metallo-aria e, in particolare la batteria Zn-aria con una densità energetica teorica quattro volte superiore a quella delle attuali batterie agli ioni di litio, pur essendo molto più economiche e sicure, sono anche promettenti fonti di energia. La reazione di riduzione dell’ossigeno catodico costituisce, per questo tipo di batterie, l’elemento fondante e può essere ottenuta tramite elettrocatalisi.
L’attività degli elettrocatalizzatori basati sui metalli del gruppo del platino ovvero platino, palladio, rodio, rutenio, iridio e osmio è stata notevolmente migliorata. Inoltre i catalizzatori a base di metalli non preziosi come i siti doppi Fe-Co incorporati su carbonio poroso drogato hanno dimostrato un’attività più elevata rispetto al Pt/C commerciale anche in condizioni acide. Anche la durabilità dei catalizzatori usati nella reazione di riduzione dell’ossigeno è stata rafforzata mettendo a punto le composizioni e le architetture per le applicazioni pratiche.
Reazione di evoluzione dell’ossigeno
La reazione di evoluzione dell’ossigeno è il processo di generazione di ossigeno molecolare mediante una reazione chimica, solitamente dall’acqua.
La semireazione di ossidazione che avviene in ambiente acido è:
2 H2O(l)→ O2(g) + 4 H+(aq) + 4 e–
La semireazione che avviene in ambiente basico è:
4 OH–(aq)→ O2(g) + 2 H2O(l) + 4 e–
La scissione elettrocatalitica dell’acqua è considerata un metodo promettente per generare energia rinnovabile e sostenibile dall’idrogeno. Gli elettrocatalizzatori a base di metalli di transizione, che offrono la possibilità di realizzare OER a basso costo, ad alta attività e stabili in soluzione alcalina, hanno pertanto attirato un notevole interesse di ricerca negli ultimi anni.
Reazione di evoluzione dell’idrogeno
La reazione di evoluzione dell’idrogeno, che avviene secondo la semireazione di riduzione dello ione H+ con formazione di H2, è un classico esempio di reazione di trasferimento di due elettroni è la semireazione catodica complementare all’ OER nella scissione elettrochimica dell’acqua. Nell’elettrocatalisi vengono utilizzati elettrocatalizzatori per promuovere reazioni elettrochimiche e la loro funzione principale è quella di adsorbire i reagenti sulla superficie per formare intermedi, promuovendo così un trasferimento di carica tra elettrodi e reagenti.
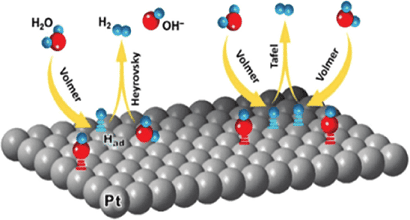
A causa del loro eccellente assorbimento dell’idrogeno, il platino e i suoi composti sono tra i migliori catalizzatori per la reazione di evoluzione dell’idrogeno. Tuttavia, il loro costo elevato e la loro scarsità ne limitano le applicazioni su larga scala. Pertanto, vari materiali, tra cui grafene, nanotubi di carbonio, dicalcogenuri di metalli di transizione, ossidi di metalli di transizione, carburi di metalli di transizione, fosfuri metallici, polimeri organici e nitruri sono stati ampiamente studiati per sostituire i catalizzatori a base di platino.
In particolare nell’ambito dell’elettrocatalisi è stata rivolta una particolare attenzione agli MXeni, aclasse di composti inorganici bidimensionali , costituiti da strati su scala atomica di carburi, nitruri o carbonitruri di metalli di transizione che hanno un’elevata area superficiale, un’ottima conduttività elettrica e una forte stabilità chimica e meccanica.
Reazione di riduzione della CO2
La reazione di elettroriduzione dell’anidride carbonica è una reazione emergente di elettrocatalisi in quanto è promettente per la conversione della CO2 in combustibili o sostanze chimiche a valore aggiunto ed ha il potenziale per diventare uno dei principali fattori che contribuiscono alla produzione sostenibile di combustibili e prodotti chimici.
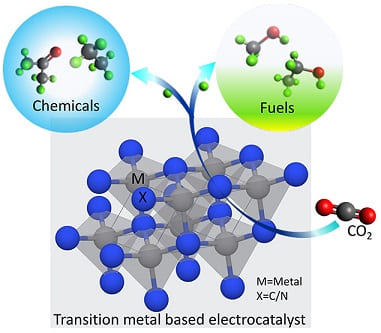
Tuttavia poiché il biossido di carbonio è una molecola stabile e scarsamente reattiva i catalizzatori sono, in genere, poco selettivi e mostrano l’incapacità di mantenere un’elevata attività catalitica per lungo tempo. Occorre pertanto selezionare, nell’elettrocatalisi, catalizzatori efficienti. L’unico metallo in grado di ridurre la CO2 in idrocarburi, aldeidi e alcoli è il rame. Per migliorare la selettività e l’attività della reazione sono stati studiati diversi catalizzatori a base di metalli e leghe che risultano, tuttavia costosi o necessitano di essere drogati con metalli nobili.
Nell’ambito della chimica verde hanno attirato l’attenzione dei ricercatori catalizzatori di carbonio non metallici drogati con azoto che utilizzano come precursore la biomassa che potrebbero raggiungere un’attività paragonabile a quella dei catalizzatori tradizionali



