Ibridazione sp2: esempi
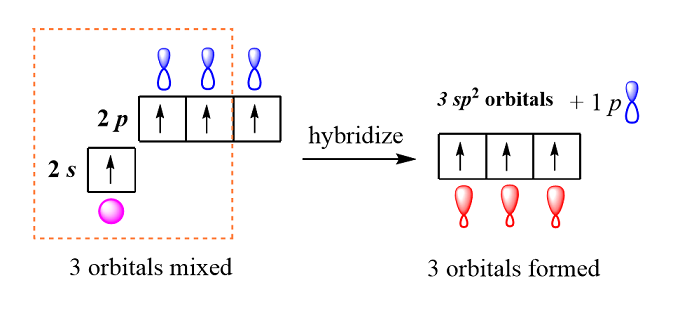
L’ibridazione sp2 può avvenire tra un atomo che ha un elettrone spaiato in un orbitale s e almeno due nell’orbitale p
Nell’ibridazione sp2 infatti un elettrone appartenente all’orbitale s e due elettroni appartenenti all’orbitale p formano 3 orbitali ibridi ciascuno dei quali ha il 33.3 % di carattere s e il 66.7 % di carattere p.
Gli orbitali ibridi sp2 sono planari e sono orientati con un angolo di 120°.
Il chimico statunitense Linus Pauling sviluppò per primo la teoria dell’ibridazione nel 1931 per spiegare la struttura di molecole semplici come il metano utilizzando gli orbitali atomici
Ibridazione sp2 del carbonio
Uno degli atomi tipici è quello di carbonio il quale ha configurazione elettronica 1s2, 2s2, 2p2. A seguito della promozione di un elettrone dall’orbitale 2s all’orbitale 2p presenta 4 elettroni spaiati. L’elettrone del livello 2s e due elettroni del livello 2p formano 3 orbitali ibridi sp2 mentre il rimanente elettrone 2p non ibridato è perpendicolare al piano dei tre orbitali ibridi
Un atomo di carbonio ibridato sp2 forma 3 legami σ e un legame π come avviene, ad esempio, negli alcheni e nei composti contenenti il gruppo carbonilico.
Sebbene il carbonio costituisca l’esempio classico per comprendere l’ibridazione sp2, oltre che quella sp3 e sp, vi sono altri possibili casi.
Trifluoruro di boro
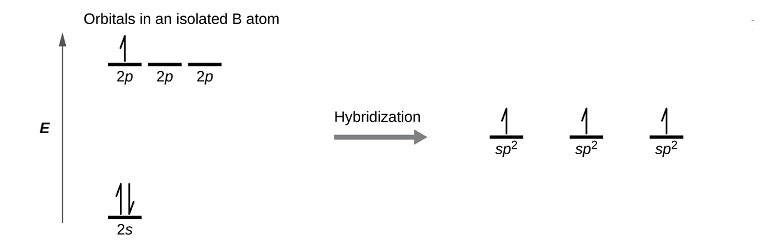
Il boro, ad esempio ha configurazione elettronica 1s2, 2s2, 2p1. A seguito della promozione di un elettrone dall’orbitale 2s all’orbitale 2p ha tre elettroni spaiati con i quali forma tre orbitali ibridi sp2 che si dispongono planarmente secondo angoli di 120°.
Proprio a causa della disposizione di tali orbitali ibridi il boro, quando si lega a tre atomi uguali come ad esempio in BF3 nonostante l’elevata differenza di elettronegatività tra gli atomi dà luogo alla formazione di una molecola apolare
Oltre che nel doppio legame degli alcheni e nel trifluoruro di boro questo tipo di ibridazione si verifica in altri composti come ad esempio BH3 e AlCl3