Idrossiacidi: nomenclatura, sintesi, reattività
Per idrossiacidi si intendono quei composti che contengono nella loro molecola gruppi carbossilici e uno o più gruppi alcolici o fenolici. Essi possono essere classificati in base alla distanza relativa fra la funzione alcolica e quella carbossilica.
I più noti presentano il gruppo -OH in posizione adiacente ovvero in posizione α rispetto al gruppo carbossilico e sono indicati con l’acronimo AHA o distanziati di un carbonio ovvero in posizione β e sono indicati con l’acronimo BHA.
Gli AHA sono utilizzati da secoli come agenti esfolianti e sono una famiglia di acidi derivati dal latte o dalla frutta: acido lattico (latte), acido glicolico (canna da zucchero), acido malico (mele), acido citrico (agrumi) e acido tartarico (uva).
Nomenclatura degli idrossiacidi
La denominazione i secondo le normative I.U.P.A.C. si ottiene prendendo come nome base quello dell’acido carbossilico e indicando la funzione –OH con il prefisso idrossi-, preceduto dal numero d’ordine indicando la sua posizione. Ad esempio:

1) Si individua la catena lunga che è costituita da 4 atomi di carbonio
2) Si individua il gruppo –OH posizionato sul secondo carbonio essendo il carbonio numero uno quello del gruppo acido
Quindi il nome è acido 2-idrossibutanoico
L’acido seguente
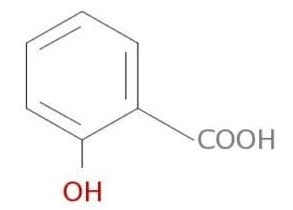
invece è denominato acido 2-idrossibenzoico o acido ortobenzoico.
Metodi di sintesi
Possono essere sintetizzati in diverse maniere a seconda del numero di atomi di carbonio che separa le due funzioni
- Sintesi di α-idrossiacidi (AHA)
a) Idrolisi di cianidrine:
>C=O + HCN → cianidrina
idrolisi della cianidrina → α-idrossiacido
b) Reazioni di chetoacidi con basi. Le α-chetoaldeidi reagiscono con le basi dando una reazione di Cannizzaro incrociata che porta alla formazione di α-idrossiacidi
c) Sintesi di Kolbe-Schmidt dell’acido salicilico. I fenati reagiscono con anidride carbonica dando carbossilazione in orto
d) Idrossilazione di acidi aromatici. Per riscaldamento dei sali rameici degli acidi benzoici in si ottengono idrossiacidi aromatici
- Sintesi di β-idrossiacidi (BHA)
a) Reazione di Reformatsky. Le aldeidi e i chetoni reagiscono con α-bromoesteri in presenza di zinco per dare β-idrossiesteri, dai quali per idrolisi si ottengono i β-idrossiacidi
b) Reazione di Perkin. Se è usata come condensante un’anidride con un solo idrogeno acido in α a ogni carbonile non si verifica la disidratazione ad acidi α,β-insaturi e si isolano solamente β-idrossiacidi
c) Riarrangiamento di Favorskii. Per trattamento di α,β-epossichetoni con basi si ottengono come prodotti di riarrangiamento gli α-idrossiacidi
Quelli γ- e δ- sono generalmente preparati per riduzione degli analoghi chetoacidi o dai carboidrati.
Reattività
In essi sia l’ossidrile che il carbonile conservano le caratteristiche di questi gruppi funzionali, per cui reagiscono come nei composti monofunzionali. Esistono, però delle reazioni in cui la presenza delle due funzioni conferisce alla molecola una reattività particolare.
1) Disidratazione. La reazione di disidratazione è un metodo che permette di riconoscere la posizione dell’ossidrile rispetto al carbossile in quanto i diversi idrossiacidi reagiscono in maniera differente.
a) α-idrossiacidi. Per riscaldamento eliminano acqua con facilità attraverso un processo intermolecolare
b) β-idrossiacidi. L’eliminazione di acqua porta alla formazione di acidi α,β-insaturi
2) Ossidazione di α-idrossiacidi. Per ossidazione con tetracetato di piombo Pb(OCOCH3)4 danno aldeidi e chetoni
Usi
Le formulazioni contenenti idrossiacidi sono utilizzate nella pratica clinica da decenni per trattare una varietà di condizioni della pelle. I rappresentanti più importanti di questa classe di composti sono l’acido glicolico, l’acido lattico e l’acido salicilico e utilizzati, generalmente in concentrazioni comprese tra il 2% e il 70%, per trattare l’acne, l’ittiosi, le cheratosi, le verruche, la psoriasi, la pelle invecchiata.
Questi miglioramenti sono stati misurati come diminuzioni della ruvidità, dello scolorimento, della cheratosi solare e della pigmentazione generale, nonché come aumento della densità del collagene e miglioramento della qualità delle fibre elastiche



