Decarbossilazione degli acidi carbossilici: meccanismo
La decarbossilazione è una reazione chimica di eliminazione in cui viene allontanata anidride carbonica a seguito della rimozione di un gruppo carbossilico.
Gli acidi carbossilici e i loro sali possono dar luogo a decarbossilazione ma la velocità della reazione è molto bassa. Le reazioni di decarbossilazione hanno una ricca storia nella sintesi organica, comprese le sintesi di cubano e morfina.
Tuttavia, le decarbossilazioni classiche utilizzano tipicamente temperature elevate e/o acidi o basi forti. In anni più recenti, sono state segnalate molte decarbossilazioni catalizzate da metalli condizioni meno difficili, sebbene siano ancora necessari gruppi stabilizzanti gli anioni.
Condizioni per la decarbossilazione
Gli acidi carbossilici pertanto non danno questo tipo di reazione anche a caldo ma se sul carbonio in β al gruppo carbossilico è presente un gruppo elettronattrattore si verifica in genere la perdita di CO2 a una temperatura di 100-150°C.
In particolare gli acidi carbossilici che presentano un gruppo chetonico in β al gruppo carbossilico o gli acidi β bicarbossilici (1,3-bicarbossilici) eliminano biossido di carbonio con facilità ed alcuni β-chetoacidi danno decarbossilazione anche a temperatura ambiente.
In presenza di un gruppo elettronattrattore sul carbonio in β al gruppo carbossilico aumenta in modo marcato l’acidità dell’idrogeno in α e il secondo gruppo carbonilico può essere allontanato facilmente tramite decarbossilazione e pertanto questo tipo di reazioni possono essere utilizzate nella sintesi di chetoni.
Meccanismo
Il meccanismo di decarbossilazione di un β-chetoacido procede attraverso la formazione di un intermedio ciclico a 6 membri:
Analogamente l’acido propandioico noto come acido malonico che è un acido 1,3-bicarbossilico dà luogo alla decarbossilazione con formazione di acido acetico e anidride carbonica

Oltre ai β-chetoacidi e agli acidi β bicarbossilici altri derivati degli acidi carbossilici contenenti un gruppo elettronattrattore in β al gruppo carbossilico danno luogo a decarbossilazione come, ad esempio, l’acido 2,2,2-tricloroetanoico Cl3CCOOH, l’acido 2-nitroetanoico O2N-CH2COOH e l’acido 2-cianoetanoico N≡CCOOH e, tra gli acidi aromatici l’acido o,o,p-trinitrobenzoico.
Anche l’acido 3-butenoico CH2=CH-CH2COOH dà luogo a decarbossilazione a una temperatura maggiore di 200°C per dare propene e anidride carbonica:
CH2=CH-CH2COOH → CH2=CH-CH3 +CO2
Dall’elettrolisi di carbossilati di sodio o potassio, nota come elettrolisi di Kolbe, si possono ottenere radicali che si formano per trasferimento di un elettrone dello ione carbossilato all’anodo secondo le due semireazioni:
all’anodo: RCOO– → RCOO∙ + 1 e–
al catodo: Na+ + 1 e– → Na
Il radicale formatosi dà luogo alla formazione di un radicale idrocarburico e anidride carbonica:
RCOO∙ → R∙ + CO2
Il radicale idrocarburico può dimerizzare per dare un idrocarburo:
R∙ + R∙ → R-R
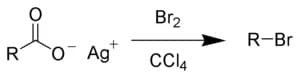
I sali di argento di un acido carbossilico invece danno luogo a una decarbossilazione in presenza di alogeni per dare un alogenuro alchilico. La reazione, che avviene in tetracloruro di carbonio, è nota come reazione di Hunsdiecker