Riarrangiamento di Wagner-Meerwein
Il riarrangiamento di Wagner-Meerwein è una reazione organica utilizzata per convertire un alcol in un’olefina utilizzando un catalizzatore acido. Il meccanismo inizia con la protonazione dell’alcol che viene poi rilasciato come acqua per formare un carbocatione.
Si verifica quindi uno spostamento 1,2 in cui un idrogeno, un gruppo alchilico o un gruppo arilico migra da un carbonio a un carbonio vicino per formare un carbocatione più sostituito e stabilizzato. Una deprotonazione finale con acqua produce il prodotto olefinico finale e rigenera il catalizzatore acido.
Dalla fine del XIX secolo, il riarrangiamento di Wagner-Meerwein, che è un riarrangiamento nucleofilo, ha attirato molte ricerche principalmente sui sistemi terpenoidi dove la presenza di anelli biciclici ramificati promuove riarrangiamenti cationici.
Infatti il primo riarrangiamento fu scoperto nei terpeni biciclici, come, ad esempio, la conversione dell’isoborneolo, composto biciclico organico e derivato terpenico in canfene che è un monoterpene biciclico.
Il riarrangiamento di Wagner-Meerwein comporta la migrazione 1,2 di un atomo di carbonio in strutture policicliche spesso di difficile sintesi attraverso le metodologie chimiche convenzionali. Inoltre, poiché i requisiti stereochimici per la migrazione 1,2 sono ben noti, in alcuni casi il prodotto del riarrangiamento può essere previsto e il riarrangiamento può essere utilizzato in un’analisi retrosintetica.
Nel riarrangiamento di Wagner-Meerwein, che avviene in ambiente acido, generalmente acido solforico, si verifica la formazione di un doppio legame carbonio-carbonio.
Meccanismo del riarrangiamento di Wagner-Meerwein
Nella sua forma più semplice il riarrangiamento di Wagner-Meerwein inizia con la protonazione dell’ossigeno presente nell’alcol che, tramite il suo doppietto elettronico solitario, attacca un idrogeno dello ione idronio prodotto dalla reazione di una molecola di acqua in ambiente acido.
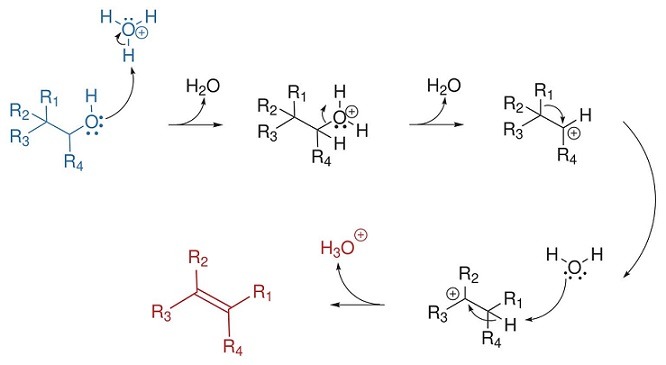
L’intermedio formatosi in cui l’ossigeno ha una carica positiva è instabile e avviene una perdita di acqua con formazione di un carbocatione che, nella figura, è un carbocatione secondario. Lo shift 1,2 del gruppo R1 presenta sul carbonio adiacente dà luogo alla formazione di un nuovo carbocatione sul carbonio adiacente che è più stabile essendo un carbocatione terziario.
L’attacco da parte del doppietto elettronico solitario presente sull’ossigeno dell’acqua all’idrogeno porta all’allontanamento di quest’ultimo come ione H+ e formazione dello ione H3O+ e formazione di un nuovo legame carbonio-carbonio. Pertanto dagli alcoli si ottengono le olefine.
Riarrangiamenti carbocationici
Il termine di riarrangiamento molecolare è esteso a tutte le reazioni in cui avviene una migrazione di un gruppo da un atomo a un atomo ad esso adiacente. Esso viola il principio di minima variazione strutturale secondo il quale le reazioni elementari non interessano mai un gran numero di specie.
Pertanto nelle reazioni di riarrangiamento essere alterato solo un numero molto limitato di legami deve , dal momento che la probabilità di rotture contemporanee di più legami è molto bassa. I riarrangiamenti dei carbocationi sono comuni nella chimica organica e sono dovuti alla trasposizione di un atomo di idrogeno o di un gruppo alchilico da un atomo adiacente all’atomo di carbonio carico positivamente al fine di ottenere un carbocatione più stabile.
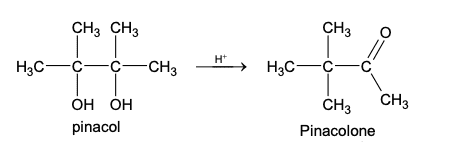
La prima reazione in cui si verifica il riarrangiamento dei carbocationi è il riarrangiamento pinacolico, scoperto nel 1860 dal chimico tedesco Rudolph Fittig in cui un glicole (1,2-diolo) viene convertito in un gruppo carbonilico in ambiente acido. Questa reazione deve il suo nome alla trasformazione del pinacolo in pinacolone ovvero del 2,3-dimetil-2,3-butandiolo in 3,3-dimetil-2-butanone.
Tra le reazioni in cui si verifica un riarrangiamento carbocationico vi è il riarrangiamento di Wagner-Meerwein. La reazione prende il nome dal chimico russo Yegor Yegorovich Vagner; che pubblicava i risultati dei suoi studi con il nome di Georg Wagner e Hans Meerwein.
Wagner aveva rivolto la sua attenzione alle strutture dei monoterpeni biciclici e, nell’ambito della sua ricerca, riuscì a determinare la relazione tra terpeni ciclici come il pinane e il bornano. Nel 1914 Meerwein, a seguito dei suoi studi sul riarrangiamento dei carbocationi, comprese il collegamento tra il pinane, il bornano.
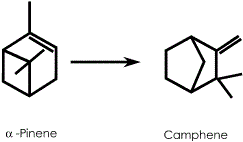
La sintesi del canfene, importante intermedio nella produzione di isoborneolo, canfora e fragranze, dall’α-pinene, avviene tramite riarrangiamento di Wagner-Meerwein. Tale reazione è stata effettuata utilizzando un processo su larga scala ed avviene sotto forma di catalisi eterogenea utilizzando quale catalizzatore il biossido di titanio idrato.
Questa reazione dovuta alla migrazione dei gruppi alchilici da un carbonio a un carbonio vicino tramite riarrangiamento di Wagner-Meerwein ha un alto significato pratico come primo passo nella sintesi industriale della canfora che è il principale costituente della trementina, dall’α-pinene.



