Reazione di acilazione di ammine e fenoli, acilazione di Friedel Crafts
La reazione di acilazione è usata in chimica organica per aggiungere ad un composto un gruppo acilico tramite un gruppo acilante come un cloruro acilico.
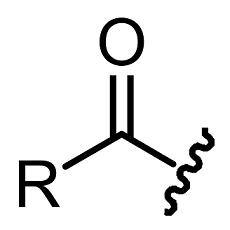
Un gruppo acilico è un gruppo funzionale con formula R-CO- costituito da un gruppo carbonilico legato e un gruppo R:
Acilazione di Friedel Crafts
La più nota reazione di acilazione è quella di Friedel Crafts in cui un composto aromatico reagisce con un alogenuro acilico per dare un chetone. La reazione avviene in presenza di un acido di Lewis come il cloruro di alluminio.
In figura è riportata la reazione tra cloruro di acetile e benzene con ottenimento dell’acetofenone
 Acilazione di ammine
Acilazione di ammine
Le ammine primarie e secondarie sia alifatiche che aromatiche, reagiscono con cloruri acilici o anidridi secondo un meccanismo di sostituzione nucleofila. I prodotti di reazione sono delle ammidi in quanto avviene una N-acilazione
In figura è rappresentata la reazione tra un’ammina primaria e un cloruro acilico con formazione di un’ammide e acido cloridrico
 Dalla reazione tra un’ammina aromatica come l’anilina con cloruro di acetile si ottiene l’N-fenilacetammide nota come acetanilide
Dalla reazione tra un’ammina aromatica come l’anilina con cloruro di acetile si ottiene l’N-fenilacetammide nota come acetanilide
 Acilazione dei fenoli
Acilazione dei fenoli
A seconda delle condizioni di reazione il fenolo e i suoi derivati reagiscono con alogenuri acilici o anidridi per dare acilazione sul:
- carbonio secondo un meccanismo di sostituzione elettrofila aromatica
- ossigeno secondo un meccanismo di sostituzione nucleofila acilica
I fenoli possono infatti reagire in due posizioni:
- sull’anello aromatico dando un arilchetone tramite una reazione di Friedel-Crafts usando AlCl3. Il prodotto della C-acilazione è più stabile e predomina in condizioni di controllo termodinamico
- sull’ossigeno fenolico che fornisce un estere tramite O -acilazione. Il prodotto dell’O-acilazione si forma più velocemente e predomina in condizioni di controllo cinetico. L’o-acilazione può essere promossa da:
- catalisi acida tramite protonazione dell’agente acilante, aumentandone il carattere elettrofilo
- catalisi di base tramite deprotonazione del fenolo, aumentandone il carattere nucleofilo
La conversione di esteri fenolici in idrossi arilchetoni per riscaldamento in presenza di un catalizzatore è noto come riarrangiamento di Fries







