Inversione di Walden
L’inversione di Walden è un processo in cui la struttura delle molecole viene modificata nel corso della reazione e comporta l’inversione di un centro chirale in una molecola durante una reazione chimica. Dato che una molecola può formare due enantiomeri distinti attorno a un centro chirale, l’inversione di Walden trasforma la struttura della molecola da una forma enantiomerica a un’altra.
Il concetto di inversione di Walden fu introdotto per la prima volta dal chimico russo, lettone e tedesco Paul Walden noto per il suo lavoro sulla stereochimica nel 1896. I suoi lavori furono pubblicati “Manuale di stereochimica” a seguito di numerose sintesi e ricerche.
Per quasi due decenni dopo la sua prima divulgazione, l’inversione di Walden rimase un enigma meccanicistico e i dettagli esatti erano ancora oggetto di speculazione. Si dovette attendere il 1911 quando il chimico svizzero Alfred Werner diede una spiegazione plausibile per il cambiamento di configurazione
Reazione dell’inversione di Walden
La reazione dell’inversione di Walden a cui il chimico fece riferimento è il processo di conversione dell’acido malico in clorosolfonico attraverso una reazione con pentacloruro di fosforo in cui si rilevò un’inversione della rotazione ottica.
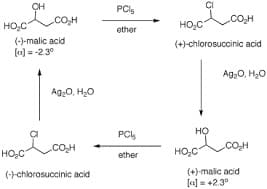
Walden dimostrò che (+) l’acido malico poteva essere convertito in (+) o (-) acido clorosuccinico (acido 2-clorobutandioico) utilizzando diversi reagenti. Sebbene all’epoca non fosse nota la configurazione assoluta di ciascuna sostanza, era chiaro che uno di questi processi avveniva per inversione di configurazione nello stereocentro e l’altro per ritenzione.
L’inversione di Walden si riferisce all’inversione della configurazione stereochimica in uno stereocentro durante una reazione chimica ed è opposta alla ritenzione della configurazione ritenzione in cui la simmetria del substrato prima e dopo la reazione rimane la stessa.
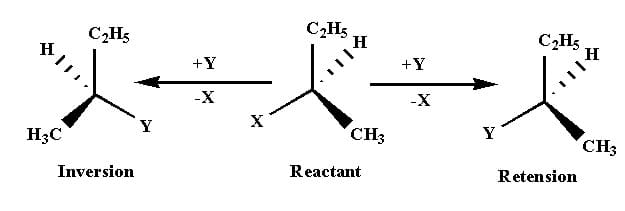
Nelle reazioni di sostituzione nucleofila quando il nucleofilo attacca un carbonio chirale dallo stesso lato in cui è presente il gruppo uscente, si verifica la ritenzione della configurazione. Quando il nucleofilo attacca il carbonio chirale dalla direzione opposta dove è presente il gruppo uscente si ottiene l’inversione di configurazione.
Pertanto una reazione di sostituzione nucleofila che segue il meccanismo SN2 mostra l’inversione di configurazione mentre quelle che seguono il meccanismo SN1 si forma una miscela racemica dalla quale un prodotto mostra ritenzione di configurazione e un altro prodotto mostra inversione di configurazione.
Sostituzione nucleofila SN2
In una reazione di sostituzione nucleofila un nucleofilo attacca un atomo di carbonio a cui è legato un buon gruppo uscente formando un nuovo legame:
Nu– + R-X → R-Nu + X–
La sostituzione nucleofila via SN2 avviene con un meccanismo concertato bimolecolare. La velocità della reazione è direttamente proporzionale a quella del nucleofilo e del substrato secondo la legge cinetica del secondo ordine:
v = k [Nu–][R-X]

Il carbonio legato al gruppo uscente ha una parziale carica positiva e viene attaccato del nucleofilo con formazione, nello stato di transizione, di un intermedio. In esso inizia a rompersi il legame tra il carbonio e il gruppo uscente e inizia a formarsi il legame tra nucleofilo e carbonio.
Questo meccanismo è meglio compreso dall’analisi del profilo della reazione in cui è riportata l’energia in funzione della coordinata di reazione. La reazione avviene quindi in un unico stadio e con un solo stato di transizione.
Contrariamente alle reazioni di sostituzione che avvengono tramite meccanismo SN1 non si verifica la formazione di un carbocatione. Lo stato di transizione presenta 5 gruppi intorno al carbonio legato al gruppo uscente quindi i substrati che presentano uno scarso ingombro sterico danno luogo a questo tipo di meccanismo.

Poiché il nucleofilo è coinvolto nello stadio che determina la velocità della reazione, la natura del nucleofilo è particolarmente importante. Quanto maggiore è reattivo il nucleofilo tanto più la reazione avverrà via SN2 piuttosto che via SN1.
Un esempio è la reazione tra l’(R)-2-bromobutano con OH–. Quest’ultimo attacca il carbonio chirale dal lato opposto rispetto al gruppo uscente con formazione di uno stato di transizione. A seguito della fuoriuscita del gruppo uscente il prodotto di reazione è l’(S)-2-butanolo in cui si è verificata l’inversione



