Acido tungstico
L’acido tungstico, scoperto dal chimico svedese Carl Wilhelm Scheele nel 1781, è un acido ternario in cui il tungsteno ha numero di ossidazione +6. Ha formula H2WO4 e deriva formalmente dall’idratazione dell’ossido di tungsteno (VI) WO3. Esso infatti può essere rappresentato come WO3· H2O sebbene possa essere rinvenuto nella forma semiidrata WO3· ½ H2O

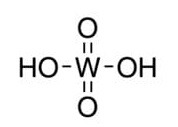
L’acido tungstico ha struttura tetraedrica ed è costituito da un atomo di tungsteno centrale circondato da quattro atomi di ossigeno. Il tungsteno si lega tramite legame covalente polare a due atomi di ossigeno tramite doppio legame e a due gruppi -OH tramite legame semplice.
La struttura dell’acido tungstico può essere visualizzata come un polimero di tetraedri di WO4 , collegati insieme da atomi di ossigeno condivisi e assomiglia a quella di altri poliossometallati, come l’acido molibdico e l’acido fosfotungstico.
Proprietà dell’acido tungstico
L’acido tungstico è una sostanza solida che ha un colore bianco-giallastro. È inodore e insapore ed è poco solubile in acqua, nella maggior parte dei solventi organici e in soluzioni acide ad eccezione dell’acido fluoridrico. L’ossido di tungsteno, infatti, reagisce con HF secondo la reazione:
WO3 + 4 HF → H2WO2F4 + 2 H2O
È relativamente solubile in etanolo e solubile in ammoniaca, presenta proprietà acide avendo un pKa di 1.7 e può reagire con le basi per formare sali noti come tungstati. È un forte agente ossidante e reagisce con molte sostanze, come metalli, non metalli e composti organici. Può essere ridotto a triossido di tungsteno mediante riscaldamento in atmosfera riducente.
È stabile a temperatura ambiente, ma si decompone a temperature più elevate, rilasciando acqua e formando triossido di tungsteno. È generalmente considerato a bassa tossicità, ma l’esposizione ad alte concentrazioni può causare irritazione del tratto respiratorio e digestivo.
Sintesi
L’acido tungstico può essere preparato attraverso varie vie sintetiche a partire, ad esempio, dal tungstato di sodio Na2WO4 o dal paratungstato di ammonio [(NH4)10H2W12O42] per reazione con un acido come acido cloridrico o acido nitrico secondo la reazione:
Na2WO4 + 2 HCl → H2WO4 + 2 NaCl
Un altro metodo di sintesi prevede la reazione tra ossido di tungsteno (VI) e acqua:
WO3(s) + H2O(l) → H2WO4(s)
L’acido tungstico può essere preparato dalla reazione tra tungsteno e perossido di idrogeno:
W + 3 H2O2 → H2WO4 + 2 H2O
Un altro metodo di sintesi prevede la reazione tra tungstato di sodio e bicarbonato di sodio:
Na2WO4 + 2 NaHCO3 → H2WO4 + 2 Na2CO3
Reazioni
Grazie alle sue proprietà acide l’acido tungstico reagisce con le basi per dare i tungstati. A seguito della reazione con idrossido di sodio dà luogo alla formazione di tungstato di sodio secondo la reazione di neutralizzazione:
H2WO4 + 2 NaOH → Na2WO4 + 2 H2O
Può reagire con acidi forti come l’acido solforico per dare poliossometallati e, quale ossidante, può essere utilizzato per ossidare una varietà di composti organici e inorganici. È un buon agente ossidante e può essere usato per ossidare composti organici e inorganici.
Usi
L’acido tungstico può essere utilizzato nella produzione di acido 4-idrossibenzoico, che è un intermedio nella sintesi della vitamina C. È un catalizzatore eterogeneo a basso costo e facilmente disponibile che presenta un’elevata efficienza catalitica ed è usato quale catalizzatore nelle reazioni di ossidazione degli alcoli terpenici, di idrossilazione delle olefine.
Inoltre catalizza in modo efficace la condensazione di indoli con isatine, note anche come tribuline, per formare corrispondenti derivati ossindolici con rese elevate. Può essere impiegato come fotocatalizzatore nella degradazione degli inquinanti organici, nella scissione dell’acqua per la produzione di idrogeno e in altre reazioni fotocatalitiche.

Viene utilizzato quale mordente e nella produzione di pigmenti e coloranti. È utilizzato nell’industria tessile in quanto conferisce un colore giallo ai tessuti. Viene impiegato anche nella produzione di inchiostri e vernici a base di tungsteno. È usato quale componente nella preparazione di soluzioni elettrolitiche per l’elettrodeposizione e, in particolare, nella placcatura di tungsteno.
Viene utilizzato come componente nella formulazione di vetri per migliorarne l’indice di rifrazione e le proprietà ottiche. L’acido tungstico viene utilizzato anche come fondente negli smalti ceramici per migliorarne le proprietà di fusione e aderenza.



