Transizioni elettroniche
Le transizioni elettroniche avvengono quando un elettrone passa da uno stato detto fondamentale a uno stato detto eccitato a seguito di assorbimento di energia. Una volta nello stato eccitato, l’elettrone ha un’energia più elevata e torna nuovamente nello stato inferiore emettendo energia sotto forma di fotoni. Il primo a teorizzare questo fenomeno fu il fisico danese Niels Bohr nel 1913 e in seguito James Franck e Gustav Ludwig Hertz dimostrarono sperimentalmente che gli atomi hanno stati energetici quantizzati.
Gli elettroni responsabili delle transizioni elettroniche sono gli elettroni coinvolti nel legame σ, nel legame π e gli elettroni n non coinvolti in alcun legame ma presenti nel guscio esterno come doppietto elettronico solitario.
Vi sono inoltre le transizioni elettroniche che avvengono nei complessi a trasferimento di carica ovvero quelli formati dall’associazione di due o più molecole in cui una frazione di carica elettronica è trasferita da una entità all’altra legate tra loro da una forza di attrazione elettrostatica essendo costituite da un donatore di elettroni e un accettore di elettroni.
Tipi di transizioni elettroniche
La promozione degli elettroni dallo stato fondamentale a uno stato energetico superiore può essere classificata in quattro tipi di transizioni elettroniche.
Transizioni elettroniche σ → σ*
questo tipo di transizione avviene da orbitali di legame a orbitali di antilegame. Questo processo richiede un’alta energia in quanto i legami di tipo σ sono generalmente forti la transizione avviene con una radiazione ad elevata frequenza e bassa lunghezza d’onda.
Ad esempio il metano che presenta solo legami C-H e può dar luogo solo a transizioni elettroniche σ → σ* mostra un massimo di assorbanza a 125 nm che pertanto non ricade nel campo del visibile bensì dell’U.V.

Transizioni elettroniche n → σ*
questo tipo di transizione coinvolge elettroni n di non legame e avviene da un orbitale di non legame n a orbitali di antilegame e avviene a una lunghezza d’onda compresa tra 150 e 250 nm. Questa transizione è tipica di composti saturi contenenti eteroatomi che presentano doppietti elettronici solitari come, ad esempio gli alogenuri alchilici ma è tipica anche negli alcoli, ammine e eteri.
Transizioni elettroniche π → π*
questo tipo di transizione coinvolge elettroni π che sono eccitati dall’orbitale di legame π al legame di antilegame π*. Questo tipo di transizione richiede una minore energia e pertanto avviene a una lunghezza d’onda compresa tra 200 e 700 nm. Questa transizione è tipica di composti insaturi contenenti un doppio legame come aldeidi, chetoni, alcheni, alchini, composti aromatici e nitrili.
Transizioni elettroniche n → π*
questo tipo di transizione coinvolge elettroni n di non legame e avviene da un orbitale di non legame n a un orbitale di antilegame π*. Avviene in composti contenenti doppi legami in cui sono presenti eteroatomi con doppietti elettronici solitari come, ad esempio, C=O, C=S e N=O. Questa transizione richiede, rispetto alle altre, l’energia più bassa e quindi maggiori lunghezze d’onda.
Transizioni elettroniche d-d e f-f
La maggior parte dei complessi dei metalli di transizione sono colorati sia allo stato solido che in soluzione acquosa. Ciò è dovuto alla presenza di orbitali d riempiti parzialmente. Quando si forma un complesso di un metallo di transizione, gli orbitali degeneri d del metallo si suddividono quindi in due gruppi a diversa energia detti t2g a cui appartengono gli orbitali dxz, dyz, dxy ed eg a cui appartengono gli orbitali dz2 e dx2-y2.
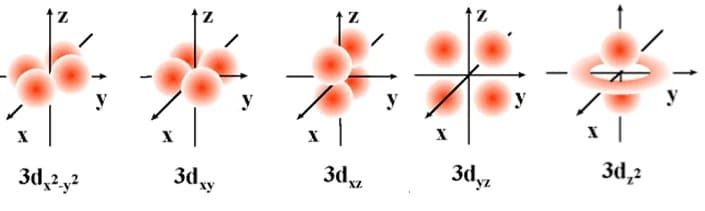
Quando la luce bianca cade su questi composti gli elettroni assorbono determinate frequenze della radiazione elettromagnetica dando luogo a transizioni elettroniche in orbitali a maggiore energia. Queste frequenze hanno una determinata energia che corrisponde alla differenza di energia tra i diversi orbitali.
Per cationi dei metalli di transizione in genere la differenza di energia tra gli orbitali non degeneri di tipo d corrisponde all’energia di radiazione della luce visibile quindi essi assorbono una parte dello spettro della luce visibile e riflettono la parte rimanente che componendosi appare di una determinata colorazione.

Le transizioni elettroniche f-f hanno una stretta analogia con le transizioni elettroniche d-d e avvengono, invece che nei complessi di metalli di transizione con i complessi dei lantanidi e degli attinidi i cui elettroni dell’ultimo livello si trovano nell’orbitale f.
I sette orbitali f degeneri sono fz3, fxz2, fyz2, fxyz, fz(x2-y2), fx(x2-3y2) e fx(y2-3×2). Quando si forma un complesso di un lantanide o di un attinide gli orbitali degeneri f del metallo si si suddividono quindi in tre gruppi a diversa energia detti t1g, t2g e a2g sebbene la scissione del campo cristallino molto più piccola rispetto a quella dei metalli di transizione e i complessi appaiono di colori pallidi.



