Orbitali degeneri
Gli orbitali degeneri contengono orbitali elettronici che hanno lo stesso livello energetico e, secondo la regola di Hund, gli orbitali degeneri vengono riempiti uniformemente prima che gli elettroni si posizionino in livelli energetici più elevati. Quando gli elettroni degli orbitali degeneri non sono influenzati da fattori esterni, come un campo elettrico o un campo magnetico, hanno la stessa energia mentre l’applicazione di un campo magnetico la perdita della degenerazione
Esempi di orbitali degeneri sono gli orbitali presenti nel sottolivello 2 p che presentano 3 orbitali degeneri e quindi con la stessa energia detti px, py e pz. Ad esempio l’azoto che ha configurazione elettronica 1s2, 2s2, 2p3 ha 3 elettroni nel sottolivello 2p e, per la regola di Hund, essi si dispongono uno nel sottolivello 2px, uno nel sottolivello 2py e uno nel sottolivello 2pz.
Pertanto i numeri quantici relativi a questi 3 elettroni sono n = 2 dove con n si è indicato il numero quantico principale correlato all’energia dell’orbitale. Essi hanno numero quantico secondario, che definisce la forma dell’orbitale, l = 1. Tuttavia il numero quantico magnetico m che definisce il numero di orientamenti possibili nello spazio di un dato orbitale è pari rispettivamente a -1, 0 e +1.
Aufbau e orbitali degeneri
Per stabilire in quali orbitali atomici si accomodano gli elettroni, ovvero per procedere alla “costruzione” (Aufbau) ideale degli atomi si deve partire dal principio di esclusione di Pauli oltre che dalla regola di Hund e dal diagramma delle energie.

Secondo il principio di Pauli in un atomo non vi possono essere due elettroni aventi gli stessi numeri quantici, ovvero in un livello energetico vi possono essere al massimo due elettroni e, se ve ne sono due, essi hanno spin opposti.
Pertanto per l’atomo di ossigeno che ha 8 elettroni e configurazione elettronica 1s2, 2s2, 2p4 essi si dispongono uno nel sottolivello 2px, uno nel sottolivello 2py e uno nel sottolivello 2pz. Il quarto elettrone si sistema si sistema, per il principio di Pauli nell’orbitale 2px con spin antiparallelo.
Orbitali d
La perdita della degenerazione può avvenire non solo con l’applicazione di un campo magnetico ma nei complessi di metalli di transizione che presentano elettroni negli orbitali degeneri d. I cinque orbitali degeneri d sono:
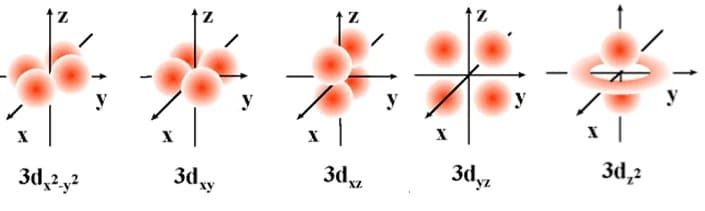
dxy: in cui i lobi si trovano tra l’asse x e l’asse y
dxz: in cui i lobi si trovano tra l’asse x e l’asse z
dyz: in cui i lobi si trovano tra l’asse y e l’asse z
dx2– y2 : in cui i lobi si trovano sugli assi x e y
dz2 : in cui due lobi si trovano sull’asse z e un anello che si trova sul piano xy tra i due lobi
Secondo la teoria del campo cristallino, elaborata dal fisico tedesco Hans Bethe nel 1929 e successivamente dal fisico statunitense John Hasbrouck van Vleck nel 1935, l’interazione tra uno ione di un metallo di transizione e i leganti sia solo di natura elettrostatica ignorando gli effetti del legame covalente.

In un complesso ottaedrico sei leganti si avvicinano allo ione metallico lungo gli assi cartesiani. Gli orbitali dx2-y2 e dz2 hanno una maggiore densità elettronica orientata lungo gli assi e subiranno una repulsione da parte dei leganti maggiore rispetto a quella degli altri orbitali. Gli orbitali dxy, dxz e dyz avendo una densità elettronica orientata tra gli assi subiranno una minore repulsione da parte dei leganti.
I cinque orbitali degeneri si suddividono quindi in due gruppi a diversa energia detti t2g a cui appartengono gli orbitali dxz, dyz, dxy ed eg a cui appartengono gli orbitali dz2 e dx2-y2. La differenza di energia Δo è detta forza del campo cristallino o separazione del campo cristallino e si può ricavare mediante spettroscopia UV-Vis.
Nel caso dei metalli che hanno 1, 2 o 3 elettroni questi si andranno a disporre negli orbitali t2g secondo il principio di massima molteplicità.
Per i metalli che hanno 4 elettroni vi sono due possibilità:
- 2 elettroni si posizionano in un orbitale t2g e i rimanenti due in ciascuno degli altri due orbitali t2g e, in tal caso si ha un complesso a basso spin
- 3 elettroni si posizionano ciascuno in un orbitale t2g e il quarto in un orbitale eg e, in tal caso, si ha un complesso ad alto spin
Per sapere quale dei due casi si verifica è necessario confrontare il valore Δ0 con il valore di p detta energia di accoppiamento. Essa rappresenta l’energia necessaria per appaiare due elettroni nello stesso orbitale che dipende dalla natura chimica dei leganti.
Se p è maggiore di Δ0 si ha un complesso ad alto spin in cui il quarto elettrone si posiziona negli orbitali eg in quanto al sistema costa meno energia promuovere l’elettrone negli orbitali più energetici anziché accoppiarli negli orbitali meno energetici mentre se p è minore di Δ0 si ha un complesso a basso spin in cui il quarto elettrone si posiziona negli orbitali t2g in quanto al sistema costa meno spendere energia per l’energia d’accoppiamento rispetto a quella che dovrebbe spendere per superare il gap ottaedrico.



