Proteine fibrose
Le proteine fibrose sono costituite da catene polipeptidiche di natura allungata o fibrosa che formano strutture filamentose. Tali strutture sono simili a fogli e tendono a essere resistenti alla solubilizzazione in acqua e presentano una buona resistenza meccanica.
Le proteine fibrose, infatti, si differenziano dalle proteine globulari caratterizzate da elevata solubilità che si trovano in forma libera nel citoplasma e nell’ambiente extracellulare come il fluido extracellulare e il sangue.
Per le loro caratteristiche le proteine fibrose vengono utilizzate da migliaia, di anni. Tra i vari esempi la seta e la lana sono usate per applicazioni tessili, il collagene intestinale è stato usato per suturare le ferite e i capelli fungono da sensore di umidità negli igrometri.
La struttura primaria delle proteine fibrose coinvolge molte catene ripetitive di amminoacidi, mentre la loro struttura terziaria e quaternaria coinvolge molti legami a idrogeno unitamente a ponti disolfuro e legami ionici, per formare catene parallele connesse.
Struttura delle proteine fibrose
Durante gli anni ’30 e ’40 il fisico inglese William Astbury e il suo team di ricercatori studiarono tramite i raggi X numerosi materiali fibrosi presenti in natura. Sulla base dei

modelli di diffrazione ottenuti, osservò che la struttura di ciascuna fibra era dominata da uno di un piccolo numero di diversi tipi di conformazione molecolare.
Fu solo all’inizio degli anni ’50 che furono determinate le strutture di base delle proteine fibrose. Si è scoperto che le lunghe catene proteiche, composte da sequenze di amminoacidi, potevano essere ripiegate in modo sistematico per generare un numero limitato di strutture coerenti con i dati dei raggi X.
Tali tipi di strutture furono denominare α-elica, β-foglietto e tripla elica del collagene che è la principale struttura secondaria di vari tipi di collagene. Solo negli ultimi anni, grazie ai continui miglioramenti della microscopia elettronica, sono emersi i dettagli sulla struttura delle proteine fibrose
Funzioni delle proteine fibrose
A causa delle loro proprietà le proteine fibrose non sono di tipo metabolico ma sono principalmente coinvolte nelle funzioni strutturali del corpo. La struttura di queste proteine è necessarie per formare tendini, legamenti, fibre muscolari e tessuto connettivo.
Inoltre le proteine fibrose aiutano i movimenti dei tendini e dei muscoli delle articolazioni e contribuiscono anche alla formazione di unghie e capelli. Svolgono funzioni molto diverse e complesse. Le più importanti sono quelle di protezione come, ad esempio le spine dell’istrice o di sostegno come quella della ragnatela costituita da fili microscopici creata da un ragno e generalmente destinata a catturare le prede.
A causa della rete di fibre che compongono le proteine fibrose, le loro funzioni principali consistono nel servire come materiale strutturale di supporto, resistenza e protezione per i tessuti di diversi organismi viventi. Le strutture protettive composte da proteine fibrose possono proteggere gli organi vitali dei vertebrati da shock meccanici, condizioni meteorologiche avverse o attacchi di predatori
Esempi di proteine fibrose
Cheratina
La cheratina è una proteina fibrosa scarsamente solubile a causa dell’elevata presenza di amminoacidi idrofobici. Essa presenta un elevato contenuto di zolfo di cui sono costituiti i capelli, le unghie e, negli animali gli artigli, le corna, i becchi e il carapace.
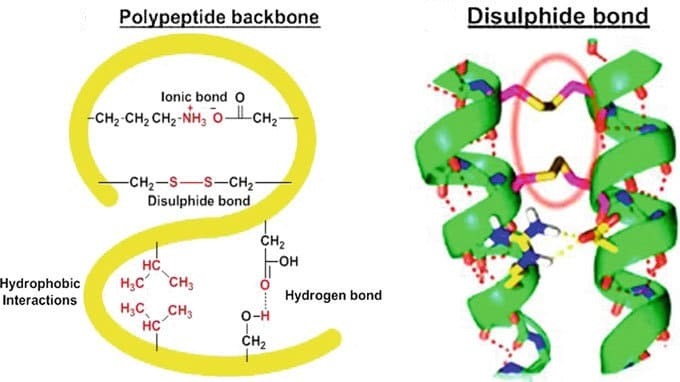
Sulla base della struttura secondaria è classificata come: α-cheratina costituita da α eliche destrorse intrecciate che è debolmente basica e β-cheratina costituita da foglietti β che è debolmente acida. Le cheratine contengono una elevata quantità di cisteina, amminoacido caratterizzato dalla presenza del gruppo –SH. I gruppi tiolici tendono ad accoppiarsi e formano un legame covalente –S-S- a seguito di una ossidazione.
I ponti disolfuro consentono alla cheratina di ottenere una struttura tridimensionale compatta con elevata resistenza alle reazioni idrolitiche chimiche o enzimatiche, contribuendo alla resilienza fisica della struttura biologica contenente cheratina.
Collagene
Il collagene appartiene a un gruppo di glicoproteine naturali che si trovano nel tessuto connettivo degli animali e fornisce supporto strutturale allo spazio extracellulare dei tessuti connettivi. Il collagene associato in fibrille si trova nei tessuti fibrosi come tendini, legamenti e nella pelle ma si rinviene anche nella cornea, nella cartilagine, vasi sanguigni e nel disco intervertebrale.
Il collagene è composto da 3 catene avvolte insieme per formare una tripla elica. Poiché la glicina è il più piccolo di tutti gli amminoacidi, consente alla catena di formare una configurazione stretta e può resistere allo stress.
Elastina
L’elastina è tra le proteine fibrose una delle più flessibili che consente alla pelle di allungarsi e torcersi, ai vasi sanguigni di espandersi e rilassarsi ad ogni battito cardiaco e ai polmoni

di gonfiarsi e contrarsi ad ogni respiro. L’elastina si trova nello strato del derma della pelle, dei polmoni, dei vasi sanguigni, dei legamenti, della cartilagine dell’orecchio e di altre parti del corpo che richiedono elasticità.
È una proteina chiave della matrice extracellulare fondamentale per l’elasticità e la resilienza di molti tessuti dei vertebrati, comprese grandi arterie, polmoni, legamenti, tendini, pelle e cartilagine elastica. I principali amminoacidi che compongono l’elastina sono la prolina, la glicina, la desmosina e l’isodesmosina raggruppati in sequenze brevi e ripetute da tre a nove amminoacidi che creano strutture forti e flessibili.
Fibrina
La fibrina, una proteina insolubile che viene prodotta in risposta al sanguinamento e costituisce il principale componente del coagulo. La fibrina è una sostanza proteica resistente disposta in lunghe catene fibrose; è formata da fibrinogeno, una proteina solubile prodotta dal fegato e presente nel plasma sanguigno.



