Manganato: proprietà, sintesi, usi
Lo ione manganato è un anione poliatomico che ha formula MnO42- in cui il manganese presenta numero di ossidazione +6. Esso è la base coniugata dell’ipotetico acido manganico H2MnO4 che è così instabile da non poter essere isolato.
L’acido idrogenomanganico HMnO4–, invece, può essere presente in soluzione ed ha un valore di pKa pari a 7.1 ed è pertanto circa 100 volte più basico dello ione acetato.
Nello ione manganato il manganese è legato a due atomi di ossigeno tramite legame doppio e a due atomi di ossigeno tramite legame semplice.
Pertanto esso si presenta in strutture stabilizzate per risonanza
Proprietà
I sali contenenti lo ione manganato hanno colore verde scuro e presentano un massimo di assorbimento a una lunghezza d’onda di 606 nm.
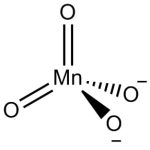
Ha geometria tetraedrica analogamente al permanganato. Gli anioni manganato, solfato e cromato hanno la stessa struttura e solubilità simili. Tuttavia, diversamente dal solfato e cromato, il manganato è paramagnetico.
Lo ione manganato è stabile in soluzione solo a pH molto elevati. Pertanto è presente come tale in soluzioni alcaline contenenti ioni che non formano idrossidi poco solubili come Na+ e K+
Sintesi
Lo ione manganato può essere ottenuto per riduzione del permanganato in soluzioni con valori di pH maggiori di 14 secondo la reazione:
4 MnO4– + 4 OH– → 4 MnO42- + 2 H2O + O2
Un altro metodo prevede la reazione del biossido di manganese con ossigeno in soluzione alcalina:
2 MnO2 + O2 + 4 OH– → 2 MnO42- + 2 H2O
Il manganato di potassio può essere ottenuto dalla reazione tra biossido di manganese, carbonato di potassio e ossigeno secondo la reazione:
2 MnO2 + 2 K2CO3 + O2 → 2 K2MnO4 + 2 CO2
Disproporzione
In presenza di acido cloridrico lo ione manganato subisce una disproporzione e si trasforma in permanganato e biossido di manganese. Si noti che il manganese presenta numero di ossidazione + 7 nel permanganato e + 4 nel biossido di manganese
Usi
I manganati sono utilizzati quali agenti ossidanti. Possono, infatti, ossidare per gli alcoli primari ad aldeidi e successivamente ad acidi carbossilici e gli alcoli secondari a chetoni



