Scala di pH: acidità e basicità
La scala di pH è una scala logaritmica correlata alla concentrazione dello ione H+ presente in una soluzione. Infatti la scala del pH è utilizzata per classificare le soluzioni in termini di acidità o basicità. Il termine pH è stato descritto per la prima volta dal biochimico danese Søren Peter Lauritz Sørensen nel 1909.
La concentrazione dello ione H+ presente in una soluzione è determinante nella maggior parte delle reazioni chimiche.
Ad esempio il perossido di idrogeno H2O2 può agire da ossidante in soluzioni acide come nella reazione:
2 MnO4– + 5 H2O2 + 6 H+ → 2 Mn2+ + 8 H2O + 5 O2
Mentre può agire da riducente in soluzioni basiche:
2 Fe3+ + HO2– + OH– → 2 Fe2+ + H2O + O2
La pepsina, uno degli enzimi dei processi digestivi, esplica la sua azione in condizioni molto acide mentre è inattiva in soluzioni neutre.
Vi sono fiori che possono essere rosa o blu a seconda dell’acidità del terreno in cui crescono.
Acidità, basicità e scala di pH
Nella vita quotidiana l’acidità e la basicità giocano un ruolo importante: già i nostri nonni sapevano, ad esempio, che quando si avverte bruciore allo stomaco si prende una soluzione di bicarbonato di sodio; l’acidità eccessiva dello stomaco è infatti neutralizzata dal sale che impartisce basicità ad una soluzione.

L’acidità di una soluzione è così importante che si è creata un’apposita scala, detta scala di pH, per la sua misurazione. Abitualmente si conviene attribuire nella scala di pH al valore 0 la massima acidità corrispondente a una concentrazione molare dello ione H+ pari a 1 M e al valore 14 di pH la massima basicità corrispondente a una concentrazione molare dello ione H+ pari a 1∙10-14 M essendo il pH definito come pH = – log [H+].
Si noti che il pH può assumere valori minori di zero ( ad esempio una soluzione in cui [H+] = 10 M ha un valore di pH = – log 10 = -1) e maggiori di 14 ( ad esempio una soluzione in cui [H+] = 10-15 M ha un valore di pH = 15).
Una soluzione è tanto più acida quanto più il valore di pH è basso mentre è basica quanto più il valore di pH è alto. A pH = 7 la soluzione è neutra.
Esempi
Esempi di soluzioni a determinati valori di pH sono riportati in tabella:
| Acido forte pH < 2 | Acido debole pH 2-6 | ∼ neutro ∼ pH 7
| Base debole pH 8-12 | Base forte pH > 12 |
| H2SO4 contenuto nella batteria pH 1 | Acido ascorbico (Vitamina C) pH ∼ 3 | Acqua deionizzata pH 7 | Dentifricio pH 8 | NaOH Idrossido di sodio pH 13-14 |
| HCl nello stomaco pH 0-1 | CH3COOH (acido acetico) pH ∼ 2-3 | Soluzione di NaCl pH 7 | Ca(OH)2 calce spenta pH 12 | KOH idrossido di potassio pH 13-14 |
| HNO3 pH 1 | Succhi di frutta di arancia o limone pH 2-3 | Soluzione di solfato di magnesio pH 6.5-7 | Na2CO3 soda pH 11 | Prodotti per la pulizia del forno pH > 12 |
| Latte pH 6 | Sangue pH 7.2-7.4 | Candeggina pH 11 | ||
| Vino/birra pH 3-6 | Saliva 6.4-6.9 | Acqua di mare pH 7.5-8.5 | ||
| Pioggia pH ∼ 5.5 Pioggia acida ∼ 3.5 | Latte umano pH 6.6-7.6 | NaHCO3 bicarbonato di sodio pH 8 | ||
| Mg(OH)2 latte di magnesia pH 10-10.5 |
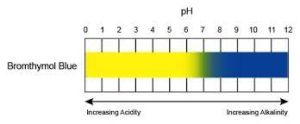
Per avere un’indicazione approssimata del pH di una soluzione si può usare una cartina universale che cambia di colore al variare del pH.
Per misure più accurate ci si può avvalere di un pHmetro costituito da una sonda (elettrodo a vetro) collegata a un dispositivo elettronico che, dopo aver raccolto il segnale della sonda, calcola il corrispondente valore di pH che viene visualizzato su un display.



