Standardizzazione del permanganato
La standardizzazione del permanganato di potassio KMnO4 si rende necessaria in quanto la specie non è uno standard primario contenendo impurezze di MnO2. Una volta fatta la standardizzazione del permanganato di potassio questa soluzione è uno standard secondario e, come tale, può essere utilizzata nell’ambito delle titolazioni permanganometriche.
Il permanganato di potassio, ottenuto per la prima volta nel 1659 dall’alchimista, farmacista e chimico tedesco Johann Rudolph Glauber trattando la pirolusite, minerale costituito da biossido di manganese con il carbonato di potassio. Si ottenne una sostanza solubile in acqua di colore verde di manganato di potassio K2MnO4 che gradualmente virò al viola. Alla fine si ottenne una soluzione di colore rosso violaceo che è la tipica colorazione delle soluzioni di permanganato di potassio

Il permanganato di potassio si solubilizza dando lo ione K+ e lo ione MnO4–, un anione poliatomico in cui il manganese ha numero di ossidazione +7 ed è un forte agente ossidante. Viene largamente utilizzato in quanto ha un potenziale normale di riduzione molto elevato: per la semireazione di riduzione in ambiente acido
MnO4–+ 8 H+ + 5 e– ⇌ Mn2+ + 4 H2O
Tale potenziale vale E° = + 1.51 V e pertanto il permanganato è in grado di ossidare specie quali Fe2+ e H2O2. Inoltre stante la caratteristica colorazione dello ione permanganato anche in soluzioni diluite, le titolazioni permanganometriche non richiedono uso di indicatore, in quanto si rileva il punto equivalente dal cambiamento di colore del permanganato che, passando da MnO4– a Mn2+, varia la sua colorazione da rosa a incolore.
Calcoli preliminari per la standardizzazione del permanganato
Si supponga di voler preparare una soluzione a titolo approssimato 0.1 N. La Normalità è una unità di misura della concentrazione di una soluzione spesso usata in chimica e, in particolare, nelle reazioni redox e definita come:
N = Eq / Volume
Si definisce grammo equivalente o semplicemente equivalente (Eq) di una sostanza, il suo peso equivalente espresso in grammi. Pertanto data la massa in grammi di una sostanza, il relativo numero di equivalenti è dato dalla formula:
Eq = g/P.E.
Il peso equivalente dello stesso elemento o della stessa sostanza dipende dalla particolare reazione cui partecipa e pertanto lo stesso elemento o la stessa sostanza può essere caratterizzato da pesi equivalenti diversi. La regola generale per calcolare il peso equivalente è la seguente:
P.E. = P.M (P.A.) / n
dove: P.M. è il peso molecolare, P.A. è il peso atomico e n è un numero intero, che assume valori diversi in dipendenza della reazione cui la sostanza partecipa.
Si tenga presente che un equivalente di una sostanza che partecipa ad una reazione redox è il numero di moli che fornisce o reagisce con una mole di elettroni. Nel caso del permanganato che si riduce a manganese (II) quindi n = 5. Pertanto per trasformare la normalità in molarità si divide per 5 quindi una soluzione 0.1 N è 0.1/5 = 0.02 M.
La massa molecolare del permanganato di potassio è pari a 158.034 g/mol e quindi il peso equivalente è pari a 158.034 /5 = 31.6. Per ottenere 1 L di soluzione 0.1 N occorrono 0.1 equivalenti pertanto la massa di permanganato di potassio deve essere pari a massa = 0.1 · 31.6 = 3.2 g
Si prepara dapprima una soluzione a titolo approssimato pesando da 3.2 a 3.3 g del permanganato di potassio e diluendo a 1 Litro con acqua distillata. Si fa bollire la soluzione per 15-20 minuti per distruggere le sostanze ossidabili presenti e, dopo raffreddamento, si filtra attraverso lana di vetro. La soluzione ottenuta ha titolo approssimato 0.1 N
Calcolo dell’ossalato di sodio per la standardizzazione del permanganato
La reazione tra permanganato di potassio e ossalato di sodio è:
2 KMnO4 + 5 Na2C2O4 + 8 H2SO4 ⇌ 5 Na2SO4 + K2SO4 + 2 MnSO4 + 8 H2O + 10 CO2
Per il calcolo della massa dell’ossalato di sodio per la standardizzazione del permanganato di potassio si deve calcolare il suo peso equivalente relativo alla semireazione di ossidazione C2O42- ⇌ 2 CO2 + 2 e– in cui il carbonio passa da numero di ossidazione +3 a numero di ossidazione +4.
Poiché il peso molecolare dell’ossalato di sodio è pari a 134.01 g/mol il suo peso equivalente vale 134.01/2 = 67 essendo 2 il numero di elettroni scambiati. Supponendo di voler effettuare la standardizzazione del permanganato di potassio utilizzando circa 25 mL gli equivalenti di KMnO4 sono pari a Eq =0.025 L · 0.1 N = 0.0025 che sono pari agli equivalenti di ossalato di sodio da pesare. Pertanto la massa di ossalato di sodio è pari a 67 · 0.0025 = 0.168 g
Si supponga di aver pesato 0.158 g di ossalato di sodio. Equivalenti di ossalato di sodio = 0.158 /67= 0.00236. Se sono stati utilizzati 24.5 mL di permanganato per raggiungere il punto finale la normalità è pari a N = 0.00236/0.0245 L = 0.0963. (La molarità della soluzione è 0.0963 /5= 0.0193 M)
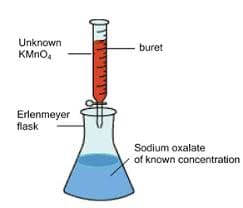
Metodica
Per la standardizzazione del permanganato di potassio si fa essiccare in stufa l’ossalato di sodio per circa 2-3 ore alla temperatura di 110°C fino a costanza di peso. Se ne pesano circa 0.17 g e si solubilizzano in 150-200 mL di acqua. Si aggiungono 10 mL di acido solforico diluito 1:4 e si scalda a 65-70 °C.

Superando questa temperatura, infatti, parte dell’ossalato si decompone. Successivamente si titola con il permanganato di potassio dopo aver ambientato e successivamente azzerato la buretta facendo gocciolare da essa il permanganato la cui colorazione all’inizio stenta a scomparire nella soluzione titolata. Quando si è formata traccia di ioni Mn2+ la reazione procede rapidamente per meccanismo autocatalitico.
Un colore rosa prodotto dalla prima goccia di KMnO4 in eccesso segnala il punto finale della titolazione. Si noti che l’acido che deve essere utilizzato nella soluzione di ossalato di sodio è l’acido solforico in quanto l’acido cloridrico, essendo un acido forte rilascia oltre a ioni H+ anche ioni Cl–. Lo ione cloruro ha un potenziale normale di ossidazione relativo alla semireazione di ossidazione 2 Cl– ⇌ Cl2 + 2 e– di – 1.36 V e viene ossidato dal permanganato



