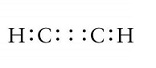Legami doppi e tripli: orbitali ibridi
I legami doppi e tripli costituiscono il grado di insaturazione di una molecola. Una molecola con un solo doppio legame ha un grado di insaturazione mentre una con un triplo legame ha due gradi di insaturazione.
La rappresentazione di molte molecole tramite la struttura di Lewis che si basa sulla regola dell’ottetto non appare possibile se si costruiscono solo legami semplici.
La regola dell’ottetto non viene quindi soddisfatta se ogni coppia di atomi legati tra loro condivide due soli elettroni.
Ad esempio consideriamo la molecola di etene C2H4 costituita da due atomi di carbonio e da quattro atomi di idrogeno. Ogni atomo di carbonio ha quattro elettroni di legame e ogni atomo di idrogeno ha un solo elettrone di legame pertanto vi sono: (2 ∙ 4) + (4 ∙ 1) = 12 elettroni di legame.
Regola dell’ottetto
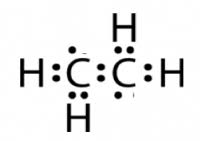
La rappresentazione della molecola di etene, rispettando la regola dell’ottetto e considerando che tra gli atomi siano presenti solo legami semplici è la seguente:
Appare tuttavia evidente che tale struttura è da scartare in quanto sono presenti 14 elettroni.
Peraltro la struttura che presenta 12 elettroni potrebbe essere quella rappresentata in figura:
Anche questa formula è tuttavia da scartare in quanto non rispetta la regola dell’ottetto.
La struttura dell’etene che invece rispetta sia la regola dell’ottetto che il numero di elettroni di legame è quella in cui è presente un doppio legame carbonio-carbonio
Ragionamento analogo può essere fatto con l’etino C2H2 in cui sono presenti (2 ∙ 4) + (2 ∙ 1) = 10 elettroni di legame per il quale l’unica struttura rispetta sia la regola dell’ottetto che in numero di elettroni di legame è quella in cui è presente un triplo legame carbonio-carbonio
Secondo la teoria del legame di valenza i legami multipli si formano dalla sovrapposizione di più di un orbitale atomico. Il secondo, così come l’eventuale terzo legame, si forma dalla sovrapposizione di orbitali non ibridati tramite la formazione di un legame π.
Sia il doppio che il triplo legame possono essere spiegati in termini di orbitali ibridi.
Orbitali ibridi
Nel caso dell’etene ogni atomo di carbonio ha tre orbitali ibridi sp2 e un orbitale p. I tre orbitali ibridi si dispongono planarmente secondo un angolo di 120° e l’orbitale p perpendicolarmente al piano.
Dalla sovrapposizione di due orbitali ibridi sp2 si forma un legame di tipo σ tra i due atomi di carbonio mentre dalla sovrapposizione dei due orbitali p si forma un legame di tipo π.
Nel caso dell’etino ciascun atomo di carbonio ha due orbitali ibridi sp che sono disposti linearmente secondo un angolo di 180°.
Gli orbitali p si trovano perpendicolari all’asse y e all’asse z. Dalla sovrapposizione di due legami ibridi si forma un legame di tipo σ mentre dalla sovrapposizione dei due orbitali py e dei due orbitali pz si formano due legami di tipo π.
Dai valori dell’entalpia di legame ovvero dell’energia necessaria a rompere il legame tra due atomi si ricava che il triplo legame ha l’entalpia maggiore rispetto al doppio legame ed infine al legame semplice quindi il triplo legame è quello più forte mentre il legame singolo è quello più debole.
Per quanto attiene la lunghezza di legame essa diminuisce all’aumentare dei legami: ad esempio la lunghezza di un legame C-C è di 154 pm, quella di un legame C=C è di 134 pm mentre quella di un legame C≡C è di 120 pm.
I doppi legami non sono presenti solo tra due atomi di carbonio ma sono presenti in numerosi composti: da quello più semplice in O2 a quelli presenti tra gli altri nel gruppo carbonilico, imminico e negli azocomposti.
Analogamente il triplo legame è presente in molecole semplici come N2 e CO ma anche, ad esempio, nei cianuri e isocianuri.