Fosgene: sintesi, usi
Il fosgene ha formula chimica è Cl-CO-Cl e il suo nome sistematico è dicloruro carbonilico. E’ una molecola planare, in accordo con la teoria V.S.E.P.R. con un angolo di legame Cl-C-Cl di 111.8°.
Fu sintetizzato dal chimico britannico John Davy nel 1812 esponendo una miscela di monossido di carbonio e cloro alla luce solare. Fu chiamato con tale nome in riferimento all’uso della luce necessaria per promuovere la reazione.
Sintesi del fosgene
Industrialmente si ottiene facendo passare monossido di carbonio e cloro su un letto di Carbonio attivo che funge da catalizzatore:
CO + Cl2 → COCl2 (ΔH = – 107.6 kJ/mol)
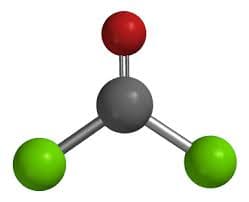
La reazione è esotermica e richiede un continuo raffreddamento del reattore. La reazione viene condotta a temperatura controllata tra i 50 e i 150 °C: oltre i 200°C il fosgene, infatti, si riconverte in monossido di carbonio ( Keq = 0.05 a 300°C).
Un’altra reazione di sintesi utilizza tetracloruro di carbonio e acqua ad alte temperature:
CCl4 + H2O → COCl2 + 2 HCl
La reattività del fosgene è quella caratteristica dei cloruri acilici:
Cl-CO-Cl + H2O →Cl-CO-OH → HCl + CO2
Cl-CO-Cl + ROH → RO-CO-Cl ( clorocarbonato di alchile ); RO-CO-Cl + ROH → RO-CO-OR ( carbonato di alchile) + HCl
Cl-CO-Cl + NH3 → H2N-CO-NH2 (urea)
Sintesi di isocianati
La gran parte del fosgene prodotto è usato per l‘ottenimento di isocianati. La sintesi di isocianati dalle ammine mostra il carattere elettrofilo del fosgene:
RNH2 + COCl2 → RN=C=O + 2 HCl
La reazione avviene in presenza di una base quale la piridina che neutralizza l’acido cloridrico che si forma nel corso della reazione.
Sintesi dei policarbonati. Il fosgene viene usato anche per la produzione di policarbonati, importante classe di polimeri termoplastici, per reazione con il bisfenolo A
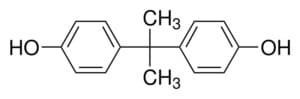
La gran parte dei processi industriali che coinvolgono reazioni con il fosgene sono condotte mediante sintesi interfacciale. Nel caso del policarbonato si tratta il bisfenolo A con NaOH in modo da ottenerne il sale sodico. Poiché il sale è solubile in fase acquosa si separa il bisfenolo A dal dal fosgene in due fasi distinte:
1) Nella fase acquosa il sale sodico del bisfenolo A
2) Nella fase organica costituita da diclorometano CH2Cl2 il fosgene
La reazione di polimerizzazione avviene all’interfaccia con produzione di cloruro di sodio.
Sintesi di cloruri acilici
Il fosgene è usato anche per l’ottenimento dei cloruri acilici a partire dagli acidi carbossilici:
RCOOH + COCl2 → RCOCl + HCl + CO2
I cloruri acilici sono importanti intermedi in quanto reagiscono con ammine e alcoli per dare rispettivamente ammidi e esteri.
Usi
Il fosgene viene largamente usato nell’industria dei coloranti.
E’ tuttavia tristemente famoso in quanto fu la prima arma chimica usata durante la Grande Guerra. In particolare durante uno degli attacchi germanici contro le linee italiane, fu usato tale gas con effetti letali. Si calcola che i morti dovuti all’uso del fosgene durante la guerra ammontino a circa 100.000.
“ Ed ecco che una cortina di nebbia biancastra prese a scivolare lentamente sul terreno, avvicinandosi sempre di più. I nostri uomini, dapprima, pensarono si trattasse di bruma del mattino, ma ben presto compresero la realtà: era un attacco con i gas” ( da una corrispondenza di guerra)
Il 24 dicembre 1935 durante la campagna d’Africa il Regio Esercito italiano ha fatto uso del fosgene sia contro i militari che contro i civili.
John Davy, appassionato e amante della chimica, quando sintetizzò per la prima volta tale composto, certamente non aveva pensato a quali utilizzi potesse essere impiegato.



