Reazione di Balz-Schiemann: prodotti di reazione, meccanismo
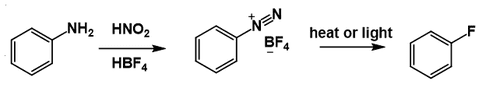
Con la reazione di Balz-Schiemann si ottiene il fluorobenzene o un suo derivato a partire dall’anilina o un’ammina aromatica primaria . La reazione prende il nome dai chimici tedeschi Günther Schiemann e Günther Balz che la scoprirono nel 1927 ed è paragonabile alla reazione di Sandmeyer, che produce anch’essa alogenuri arilici da sali di diazonio.
Nel primo stadio della reazione avviene una diazotazione ovvero una reazione tra un substrato aromatico avente un gruppo amminico primario e un reagente che può liberare un catione nitrosile come l’acido nitroso o il nitrito di sodio.
Successivamente si addiziona l’acido tetrafluoroborico con ottenimento di un sale di diazonio dalla cui decomposizione termica si ottiene il fluorobenzene.
Nel suo complesso la reazione può essere rappresentata come:
Meccanismo della reazione di Balz-Schiemann
Nel primo stadio della reazione di Balz-Schiemann lo ione nitrosile viene generato in situ pertanto si aggiunge il nitrito di sodio ad una soluzione di acida: lo ione nitrito si dissocia completamente in ione sodio e ione nitrito il quale viene protonato trasformandosi in acido nitroso:
NO2– + H+ → HNO2
La protonazione dell’acido nitroso porta a un intermedio H2NO2+ che perde acqua e si forma lo ione nitrosile:
HNO2 + H+→ H2NO2+ → NO+ + H2O
L’attacco dell’azoto amminico allo ione nitrosile porta alla formazione di un sale di diazonio secondo i seguenti stadi:
ArNH2 + NO+ → ArN+H2-N=O ⇌ Ar-NH-N=O
Poiché l’ambiente è acido l’ossigeno viene protonato:
Ar-NH-N=O + H+ ⇌ Ar-NH-N=OH+
Quest’ultimo intermedio è stabilizzato per risonanza:
Ar-NH-N=OH+ ↔ ArN+H=N-OH
La deprotonazione di tale intermedio dà:
Ar-NH-N=OH+ ↔ ArN+H=N-OH ⇌ Ar-N=N-OH
Successivamente per tautomerizzazione:
Ar-N=N-OH ⇌ Ar-N=N-OH2+
Ed infine si ottiene, per disidratazione un sale di diazonio:
Ar-N=N-OH → Ar-N=N+
Il controione del sale di diazonio deriva dall’acido tetrafluoroborico e pertanto si ha:
Ar-N=N+ BF4–
La decomposizione termica del sale di arildiazonio porta al fluorobenzene:
Ar-N=N+ BF4– → Ar-F + N2 + BF3
Le molecole fluorurate sono molto utili nel campo farmaceutico, nel settore agrochimico e come traccianti nella PET



