Isomeri costituzionali
Gli isomeri costituzionali detti anche strutturali sono composti che differiscono per connettività, cioè nel modo in cui gli atomi costituenti sono legati tra loro. Il modo con il quale gli atomi sono legati tra loro è fondamentale nel definire le proprietà di una molecola.
L’isomeria fu scoperta per la prima volta nel 1827, quando il chimico tedesco Friedrich Woehler preparò l’acido cianico e notò che sebbene la sua composizione elementare fosse identica all’acido fulminico preparato dal suo connazionale Justus von Liebig l’anno precedente, le sue proprietà erano piuttosto diverse.
Un esempio di isomeri costituzionali è fornito dall’etanolo e il dimetiletere. Entrambi i composti hanno formula C2H6O ma, sebbene le formule molecolari dei due composti sono identiche, differiscono i loro gruppi funzionali. Infatti nell’etanolo CH3CH2OH è presente un gruppo alcolico legato a un carbonio mentre, nel caso del dimetiletere CH3OCH3 l’ossigeno è legato a due atomi di carbonio.
Pertanto questi due isomeri costituzionali hanno proprietà fisiche e chimiche completamente diverse fra loro. Grazie alla presenza del legame a idrogeno l’etanolo è un liquido incolore a temperatura ambiente che presenta un’elevata volatilità mentre il dimetiletere è un gas incolore. Il punto di ebollizione dell’etanolo è di 78.37 °C mentre quello del dimetiletere è di -24°C. Inoltre mentre l’etanolo è una molecola polare il dimetiletere è una molecola apolare
Gli isomeri costituzionali possono avere gli stessi gruppi funzionali, ma si trovano in una posizione diversa dello scheletro carbonioso. Ad esempio, gli isomeri 1-propanolo e 2-propanolo hanno un gruppo alcolico su diversi atomi di carbonio.
Isomeri costituzionali degli alcani
Gli alcani con quattro o più atomi di carbonio possono isomeri costituzionali. Ad esempio l’alcano C4H10 può essere lineare CH3CH2CH2CH3 e, in tal caso si chiama n-butano mentre può presentare un gruppo -CH3 sul carbonio 2 ovvero CH3CH(CH3)CH3 e, in tal caso, si chiama 2-metilpropano o isobutano. Pur avendo la stessa formula molecolare, la stessa fase di aggregazione gassosa a temperatura ambiente e la stessa ibridazione sp3 di tutti gli atomi di carbonio, hanno diverse proprietà.
Questi isomeri costituzionali hanno, tra l’altro, diverse proprietà fisiche. Il n-butano ha una temperatura di ebollizione di – 0.5 mentre l’isobutano ha una temperatura di ebollizione di – 12°C.
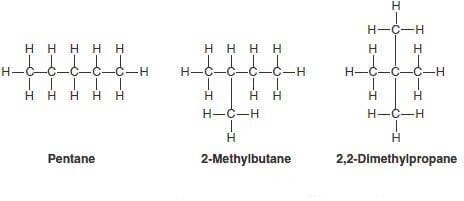
La possibilità di ramificazione aumenta all’aumentare del numero di atomi di carbonio nella catena con un aumento esponenziale del numero di isomeri costituzionali. Infatti l’alcano C5H12 ha tre isomeri costituzionali, rispettivamente n-pentano, isopentano ovvero 2-metilbutano e neopentano ovvero 2,2-dimetilpropano. L’alcano a sei atomi di carbonio ha cinque isomeri, mentre il numero di isomeri aumenta a 75 per l’alcano a 10 atomi di carbonio.
Determinazione degli isomeri costituzionali
Oltre a esaminare la connettività nelle strutture di Lewis, un altro modo per stabilire se una struttura di Lewis rappresenta la stessa molecola di un’altra struttura di Lewis è determinare il nome I.U.P.A.C. delle strutture. I nomi I.U.P.A.C. infatti sono studiati in modo tale che la stessa struttura abbia sempre lo stesso nome mentre se due strutture sono diverse, nominandole correttamente si otterranno nomi diversi.

Bisogna infatti fare attenzione perché, a prima vista due formule sembrano isomeri costituzionali, ma, in realtà, rappresentano lo stesso composto. Ad esempio, l’1,2-dicloroetano può essere scritto in diversi modi la sequenza di legame è Cl—C—C—Cl in ciascuna formula, quindi tutte e tre le formule strutturali rappresentano la stessa molecola e non sono isomeri costituzionali.

Invece l’isomero dell’1,2-dicloroetano è l’1,1-dicloroetano. Nell’1,1-dicloroetano, i due atomi di cloro sono legati allo stesso atomo di carbonio, ma nell’1,2-dicloroetano, i due atomi di cloro sono legati a diversi atomi di carbonio.
Per passare da un isomero costituzionale a un altro è necessario rompere i legami covalenti, il che richiede un significativo apporto di energia quindi gli isomeri costituzionali non si convertono dall’uno all’altro a temperatura ambiente.
Un altro metodo per valutare se vi siano isomeri costituzionali consiste nel calcolare il grado di insaturazione. Si supponga, ad esempio, di considerare la formula C3H6O. Il numero di atomi di idrogeno di un alcano si calcola con la formula CnH2n+2. Pertanto dell’alcano con 3 atomi di carbonio è C3H8 essendo n = 3. Il numero di siti di insaturazione è pari alla semisomma della differenza tra gli atomi di idrogeno presenti nell’alcano e quelli presenti nella specie in esame.
Quindi il grado di insaturazione è pari a 8-6/2 = 1. Ciò implica la presenza di un doppio legame oppure la presenza di una struttura ciclica. A questo punto si possono scrivere le possibili strutture lineari ipotizzando la presenza di un doppio legame, una volta in posizione 1 e una volta in posizione 2 ovvero:
C=C-C-O e C-C=C-O.
Sistemando gli idrogeni si ottiene dalla prima delle due strutture H2C=CH-CH2OH mentre dalla seconda non si ottiene alcuna possibile formula. Si può anche considerare un doppio legame carbonio-ossigeno ottenendosi CH3CH2CHO o un ossigeno legato a due atomi di carbonio: H2C=CH-O-C-CH3.
Dopo aver considerato le possibili strutture lineari si devono considerare quelle cicliche e quelle ramificate ottenendosi tutti i possibili isomeri strutturali



