Condensazione benzoinica: meccanismo, prodotti di reazione
La condensazione benzoinica è una reazione in cui si forma un legame carbonio-carbonio quando due molecole di aldeidi aromatiche e, in particolare la benzaldeide, reagiscono per dare un prodotto di condensazione detto benzoino.
Il benzoino è un α-idrossichetone legato a due gruppi fenile. Friederich Woehler e Justus von Liebig nel 1832 riportarono la struttura del benzoino e la condensazione benzoinica nell’ambito delle loro ricerche sull’olio di mandorle amare
La reazione può essere schematizzata come segue:

La condensazione benzoinica è catalizzata dallo ione cianuro CN– che agisce da nucleofilo . Solo nel 1903 il chimico scozzese Arthur Lapworth propose il meccanismo della reazione
Meccanismo della condensazione benzoinica
Nel primo stadio della reazione lo ione cianuro attacca il carbonio carbonilico con formazione di una cianidrina:
C6H5CHO + CN– ⇌ C6H5CH(OH)CN
La reazione avviene in presenza di etanolo e acqua.
Nel secondo stadio della reazione una base forte deprotona il carbonio con formazione di un carbanione stabilizzato per risonanza
Il carbanione formatosi può quindi agire da nucleofilo nei confronti di un’altra aldeide con formazione di un intermedio C6H5C(OH)CNCH(OH)C6H5
La base deprotona tale intermedio e si ha la fuoriuscita del gruppo CN– con formazione del benzoino
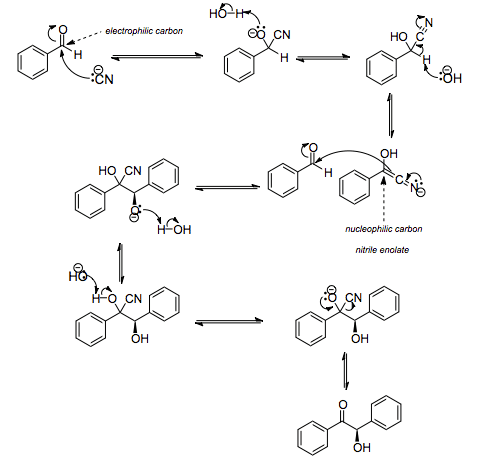
Lo ione cianuro nel corso della reazione assolve a tre scopi diversi:
- agisce da nucleofilo
- facilita la deprotonazione
- costituisce un buon gruppo uscente nello stadio finale.
A rigore la reazione dovrebbe essere chiamata dimerizzazione piuttosto che condensazione in quanto nelle reazioni di condensazione vengono allontanate molecole a basso peso molecolare come, ad esempio, l’acqua evento che non si verifica nella reazione.
La reazione può essere estesa ad aldeidi alifatiche usando quale catalizzatore un sale di tiazolo. I prodotti di tali reazioni costituiscono i precursori di composti eterociclici



