Acido cumarico: isomeria, proprietà, usi
L’acido cumarico, unitamente all’acido ferulico, acido caffeico, acido clorogenico, acido rosmarinico e all’acido sinapico fa parte degli acidi idrossicinnamici. E’ un prodotto naturale trovato, ad esempio, nella Castanopsis fissa .
Esso, infatti, è un idrossiderivato dell’acido cinnamico e formula C9H8O3 . A seconda della posizione del gruppo -OH può presentarsi sotto forma dei tre isomeri orto, meta e para.
Quest’ultimo è l’acido più presente in natura. A causa della presenza del doppio legame, a sua volta può presentarsi nella forma E e Z.

Esso, infatti, è un idrossiderivato dell’acido cinnamico e formula C9H8O3 . A seconda della posizione del gruppo -OH può presentarsi sotto forma dei tre isomeri orto, meta e para.
Quest’ultimo è l’acido più presente in natura. A causa della presenza del doppio legame, a sua volta può presentarsi nella forma E e Z.
Proprietà dell’acido cumarico
L’acido p-cumarico è un solido cristallino poco solubile in acqua. Invece è solubile in solventi organici come etanolo, dimetilsolfossido, etere etilico e dimetilformammide. Il valore della sua costante acida Ka , tipico degli acidi carbossilici è pari a 2.24 · 10-5.
L’acido p-cumarico è un antiossidante ed è classificato come fitochimico e nutraceutico. Si trova legato tramite legame estereo con monosaccaridi, disaccaridi e polisaccaridi. Esso si trova in forma glicosilata in un’ampia varietà di piante commestibili come carote, arachidi e cereali e in particolare nel chicco dell’orzo. L’acido p-cumarico è presente nelle pareti cellulari delle graminacee.
Biosintesi dell’acido cumarico
Nelle piante, la biosintesi dell’acido p -cumarico coinvolge due processi biochimici: la fenilalanina ammoniaca-liasi (PAL) catalizza innanzitutto la conversione della fenilalanina in acido trans -cinnamico, che viene poi idrossilato in posizione para sotto l’azione dell’acido trans -cinnamico 4-idrossilasi.
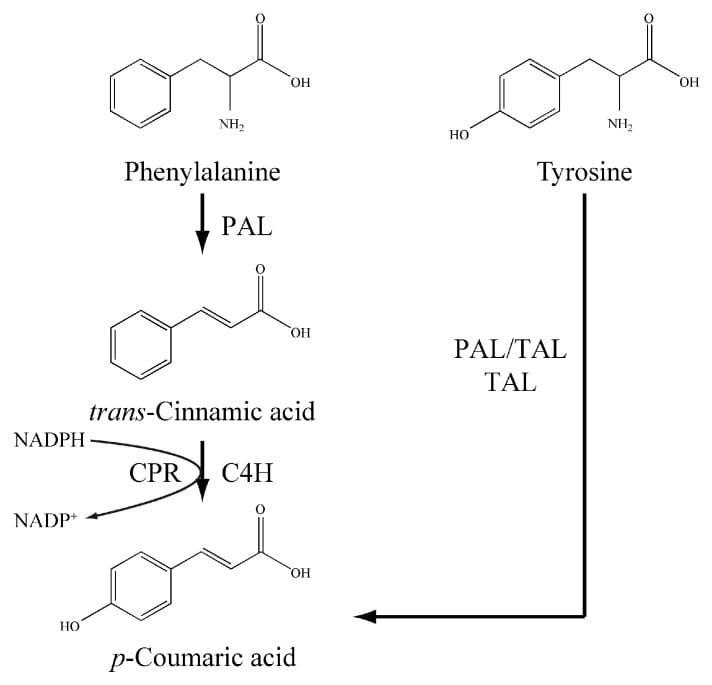
Tuttavia, alcuni enzimi fenilalanina ammoniaca-liasi possono accettare la tirosina come substrato alternativo (PAL/TAL) e formare direttamente acido p -cumarico dalla tirosina senza l’intermediazione dell’acido trans -cinnamico.
Inoltre, vi sono alcuni enzimi omologhi dell’amminoacido aromatico dell’ammoniaca-liasi specifici per la deaminazione della tirosina (TAL) quindi introducendo un PAL/TAL o TAL eterologo, l’acido p -cumarico potrebbe essere prodotto attraverso la via della tirosina in cellule ricombinanti come Escherichia coli, Saccharomyces cerevisiae, Streptomyces lividans e Pseudomonas putida.
Usi
L’acido p-cumarico riduce lo stress ossidativo e le reazioni infiammatorie. È un energico antiossidante e combatte la formazione di radicali liberi. Inoltre è usato per il controllo dell’iperpigmentazione.

Esso, infatti, è un inibitore competitivo della tirosinasi, enzima in grado di convertire l’amminoacido tirosina, in melanina, pigmento scuro polimerico sintetizzato nei melanociti.
Il controllo dell’iperpigmentazione indesiderata è una sfida importante in dermatologia e cosmetologia oggetto di studio delle industrie mediche e cosmetiche a causa della sua rilevanza per la fotoprotezione, i processi di carcinogenesi e i disturbi della pigmentazione della pelle. Le disfunzioni associate al meccanismo di sintesi della melanina causano disturbi della pigmentazione clinicamente rilevanti e l’iperpigmentazione è considerata una malattia esteticamente e clinicamente importante che può causare stress mentale e diminuire la qualità della vita



