Stadio che determina la velocità di una reazione: coordinata di reazione
Lo stadio che determina la velocità di una reazione è lo stadio più lento
Consideriamo, ad esempio, la reazione:
NO2(g) + CO(g) → NO(g) + CO2(g)
Velocità sperimentale
La cui velocità determinata sperimentalmente è data da:
v = k[NO2]2
Il meccanismo proposto per la reazione è:
1° stadio: NO2(g) + NO2(g) → NO3(g) + NO(g) (lento)
2° stadio: NO3(g) + CO(g) → NO2(g) + CO2(g) (veloce)
Sommando membro a membro le due reazioni e semplificando si ottiene la reazione iniziale: NO2(g) + CO(g) → NO(g) + CO2(g)
Energia potenziale in funzione della coordinata di reazione
Lo stadio che determina la velocità della reazione è il primo stadio. Pertanto il meccanismo proposto concorda con la velocità di reazione.
Un modo per comprendere quale sia lo stadio lento di una reazione consiste nell’interpretazione di un diagramma che mostra l’energia potenziale in funzione della coordinata di reazione.
In una reazione di sostituzione nucleofila hanno luogo due processi: la rottura del legame preesistente e la formazione di un nuovo legame. Le possibilità con cui la sostituzione avviene sono due:
1) Reazione a due stadi: 1) rottura del legame preesistente e 2) formazione di un nuovo legame. Tale meccanismo viene detto SN1
2) Reazione a uno stadio in cui formazione e rottura dei legami sono simultanee, ovvero concertate secondo un meccanismo SN2
Nel meccanismo 1) il primo stadio, che determina la velocità, è la rottura del legame con il gruppo uscente, con formazione di un carbocatione:
R-X → R+ + X– (stadio lento)
Nu– + R+ → Nu–R (stadio veloce)
In questo meccanismo la ionizzazione è lo stadio che comporta lo stato di transizione a maggiore energia che pertanto determina la velocità della reazione. La cattura del carbocatione ad alta energia da parte del nucleofilo è un processo rapido e con bassa energia di attivazione. Dal diagramma di reazione:
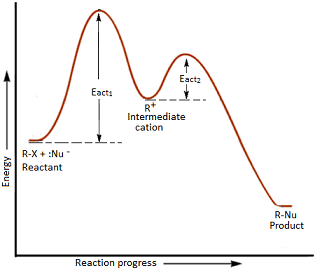
quindi si può desumere che lo stadio lento è quello che ha l’energia di attivazione maggiore ovvero il primo.
Una conseguenza della ionizzazione preliminare è che solo la concentrazione del substrato che ionizza influenza la velocità della reazione quindi la velocità è indipendente dalla concentrazione del nucleofilo: si dice che tali reazioni avvengono tramite meccanismo SN1 , sostituzione nucleofila monomolecolare.
Al contrario, nel meccanismo 2), ad uno stadio, il nucleofilo si fa strada verso il carbonio che costituisce il centro di reazione e che reca il gruppo uscente e spingendo fuori quest’ultimo simultaneamente:
Nu– + R-X → [Nu···R···X]– → Nu-R + X–
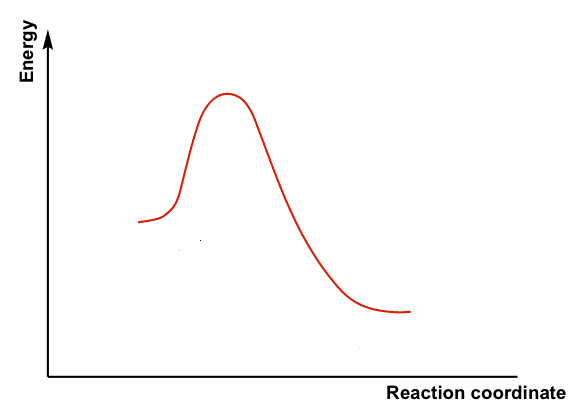
Nello stato di transizione sono presenti sia il nucleofilo che il substrato e l’energia di attivazione dipende dalla reattività dell’uno e dell’altro. La velocità di reazione dipende pertanto dalle concentrazioni di ambedue i reagenti. Questo meccanismo ad un unico stadio, detto SN2, sostituzione nucleofila bimolecolare, è un meccanismo concertato in cui il nucleofilo esercita la sua attività spostando il gruppo uscente e pertanto tali tipi di reazioni non presentano stadi lenti essendo presente un solo stato di transizione.
Stadio che determina la velocità di una reazione
Una volta nota la legge sperimentale sulla velocità di una reazione a cui il chimico svedese Svante Arrhenius diede un forte slancio, i chimici possono iniziare a studiare i possibili meccanismi di reazione. Un possibile meccanismo di reazione deve soddisfare le seguenti due condizioni:
- Le equazioni per le fasi elementari del meccanismo devono sommarsi all’equazione complessiva della reazione.
- Il meccanismo deve essere coerente con la legge sperimentale
Se il meccanismo previsto avviene in due stadi a due fasi è necessario che sia con la legge sperimentale sulla velocità della reazione. Per fare ciò, si deve sapere quale dei due stadi è quello che determina la velocità o il quale dei due è quello più lento. Poiché una reazione non può avvenire più velocemente della fase più lenta, la fase che determina la velocità limita effettivamente la velocità complessiva di una reazione.



