Ossiacidi dello zolfo: classificazione
Gli ossiacidi dello zolfo contengono zolfo, ossigeno e idrogeno; tra questi il più importante da un punto di vista industriale è l’ acido solforico. Tali ossiacidi sono classificati in base al numero di atomi di zolfo.
Classificazione degli ossiacidi
acidi contenenti un atomo di zolfo : acido solforoso H2SO3 e acido solforico H2SO4
Tra gli ossiacidi contenenti due atomi di zolfo : acido tiosolforico H2S2O3, acido ditionoso H2S2O4, acido pirosolforoso H2S2O5, acido diotionico H2S2O6, acido pirosolforico H2S2O7
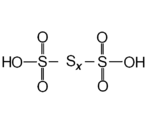
Tra gli ossiacidi contenenti tre o più atomi di zolfo vi è acido politionico: H2SxO6 ( x = 3-6)
Si annoverano infine i perossiacidi:
acido perossomonosolforico H2SO5 e acido perossodisolforico H2S2O8
L’acido solforoso è instabile e non è mai stato isolato come composto puro mentre sono noti i suoi sali. Soluzioni ottenute dall’anidride solforosa e acqua mostrano proprietà acide e furono indicate come soluzioni di acido solforoso. Tali soluzioni, invece, o non contengono acido solforoso o ne contengono quantità infinitesimali.
In tali soluzioni, invece, è presente il gas idrato SO2 · 7 H2O. Sebbene l’acido solforoso non esista come tale, sono noti i suoi sali ovvero gli idrogenosolfiti contenenti lo ione HSO3– i solfiti contenenti lo ione solfito SO32-. I sali dei metalli alcalini sono solubili in acqua. Per riscaldamento di idrogenosolfiti o facendo passare un flusso di SO2 nelle loro soluzioni acquose si ottengono pirosolfiti:
2 MHSO3 → M2S2O5 + H2O
HSO3– + SO2 → HS2O5–
Mentre i piroacidi contengono ponti a ossigeno, nello ione pirosolfito vi è un legame S-S e quindi ha struttura asimmetrica. Le soluzioni di SO2 e dei solfiti hanno carattere riducente e sono spesso impiegate come agenti riducenti:
SO32- + 2 OH– → SO42- + H2O E° = 0.93 V
L’acido solforico è una delle sostanze maggiormente utilizzate nelle industrie chimiche tanto che il suo consumo è un indice delle attività chimiche di una nazione.
Secondo la nomenclatura I.U.P.A.C. il suo nome dovrebbe essere acido tetrossosolforico (VI) ma, come per l’acido nitrico, la stessa I.U.P.A.C. consente l’uso del nome comune con il quale è universalmente noto. L’acido solforico è noto fin dal XII secolo, conosciuto come spirito di vetriolo. Ha formula H2SO4 e peso molecolare pari a 98.08 u.m.a. E’ un liquido inodore, incolore con densità 1.8391 g/cm3 a 15 °C e punto di fusione 10.37 °C. Riscaldato rapidamente bolle a 338 °C, ma poi decomponendosi libera SO3. Si dissocia secondo le reazioni:
H2SO4 → HSO4– + H+ e tale ionizzazione è completa
La seconda dissociazione è:
HSO4– ⇌ SO42- + H+ avente costante di dissociazione K = 0.010 a 25 °C.
L’acido solforico concentrato e soprattutto a caldo ossida metalli e non metalli (Ag, Cu, Hg, P, S, C ) . Diluito e freddo attacca i metalli elettropositivi (Zn, Mg, Fe) con sviluppo di H2. Energico disidratante e carbonizza rapidamente a caldo, lentamente a freddo molte sostanze organiche. L’acido solforico scioglie notevoli quantità di SO3 formando il cosiddetto oleum che viene classificato sulla base della percentuale di anidride libera. Oleum al 20% significa che su 100 parti in peso vi sono 20 parti di SO3 libera e 80 parti di H2SO4.
Acido tiosolforico. Non può essere ottenuto per acidificazione di tiosolfati poiché si decompone rapidamente in acqua dando, a seconda delle condizioni di reazione, zolfo, diossido di zolfo, solfuro di idrogeno, polisolfati, acido solforico e politionati. Può essere visto come l’acido solforico in cui un ossigeno viene rimpiazzato da uno zolfo

H2S + SO3 → H2S2O3· n Et2O ( in dietiletere a – 78°C)
Tuttavia anche l’acido anidro si decompone a temperature prossime allo zero secondo la reazione:
H2S2O3 → H2S + SO3
Acido ditionoso. E’ detto anche acido iposolforoso; è instabile infatti tende a decomporsi in SO2 e S(OH)2.
I suoi sali, i ditioniti, sono stabili: essi possono essere ottenuti per riduzione dei solfiti in soluzioni acide contenenti SO2 in eccesso e in presenza di polvere di zinco.
 Acido ditionico. L’acido ditionico è noto solo in soluzione. I suoi sali sono i ditionati che si presentano solubili in acqua. La struttura dello ione ditionato è come quella dell’etano
Acido ditionico. L’acido ditionico è noto solo in soluzione. I suoi sali sono i ditionati che si presentano solubili in acqua. La struttura dello ione ditionato è come quella dell’etano
I ditionati possono essere ottenuti dall’ossidazione di una soluzione di diossido di manganese:
2 MnO2 + 3 SO2 → MnS2O6 + MnSO4
La soluzione di diotionato di manganese può dare ditionati di altri metalli tramite reazioni di metatesi
Politionati. Gli anioni, derivanti dall’acido politionico H2SxO6 ( x = 3-6) hanno formula [O3SSx-2SO3]2-. Vengono denominati sulla base del numero complessivo di atomi di zolfo e in tali anioni gli atomi di zolfo si presentano in catena.
Miscele di politionati si ottengono per riduzione si soluzioni di tiosolfati con SO2 in presenza di As2O3.
Perossiacidi
Acido perossimonosolforico. E’ detto anche acido di Caro e si presenta liquido a temperatura ambiente. Lo zolfo ha geometria tetraedrica:
può essere ottenuto facendo reagire perossido di idrogeno con acido clorosolforico:
H2O2 + ClSO2OH → H2SO5 + HCl
Lo si può ottenere anche per idrolisi dell’acido perossidisolforico:
H2S2O8 + H2O → H2SO5 + H2SO4
E’ uno dei più forti ossidanti (E° = + 1.81 V) ed è altamente esplosivo
Acido perossidisolforico. E’ detto anche acido di Marshall; presenta lo zolfo con numero di ossidazione +6 e contiene un gruppo perossido con angoli di legame attorno a ciascun atomo di zolfo approssimativamente tetraedrici.
L’anione perossodisolfato è uno dei più energici ossidanti:
S2O82- + 2 e– → 2 SO42- E° = + 2.01 V
Le ossidazioni con S2O82- spesso decorrono lentamente per cui si adoperano catalizzatori quali lo ione argento.