Solfato di alluminio
Il solfato di alluminio è un sale con formula Al2(SO4)3 che si presenta spesso in varie forme idrate Al2(SO4)3· n H2O in cui n può assumere valori pari a 12, 16 o 18. Si trova nel minerale alunogeno, dal latino alumen che significa allume e dal greco γένος che significa origine sotto forma di Al2(SO4)3· 17 H2O.
Il solfato di alluminio in cui l’alluminio presenta numero di ossidazione +3 è un composto ionico in cui è presente un legame ionico tra l’ossigeno del solfato e l’alluminio. È un sale solubile in acqua e quando viene solubilizzato in essa subisce l’idrolisi.
Lo ione alluminio infatti reagisce con lo ione OH– dovuto all’autoionizzazione dell’acqua per dare idrossido di alluminio che precipita sotto forma di gel, a causa della sua bassa solubilità secondo la reazione netta:
Al3+(aq) + 3 OH–(aq)→ Al(OH)3(s)
Questa reazione rimuove efficacemente gli ioni OH– pertanto la reazione dello ione alluminio con l’acqua può essere scritta come:
6 H2O(l) + Al3+(aq) → 3 H3O+(aq) + Al(OH)3(s)
A causa della sua acidità il solfato di alluminio può ridurre l’alcalinità dell’acqua in cui sono presenti carbonati e carbonati acidi. Le sue soluzioni erano utilizzate già nell’antico Egitto quale mordente per aiutare il processo di tintura dei tessuti.
Sintesi del solfato di alluminio
La preparazione del solfato di alluminio può essere ottenuta attraverso diverse vie sintetiche come ad esempio dalla reazione tra alluminio e acido solforico da cui si ottiene anche idrogeno gassoso:
2 Al+ 3 H2SO4 → Al2(SO4)3 + 3H2
Un altro metodo sintetico prevede la reazione tra idrossido di alluminio e acido solforico:
2 Al(OH)3 + 3 H2SO4 → Al2(SO4)3 + 6 H2O
In tale reazione l’acido solforico viene caricato in un recipiente di reazione costituito da materiali resistenti al calore e agli acidi, e l’idrossido di alluminio viene aggiunto all’acido solforico e riscaldato, quindi la soluzione risultante di solfato di alluminio che ha un’elevata la concentrazione viene diluita con acqua e conservata nel recipiente di reazione e raffreddata, seguita dalla regolazione della concentrazione, ottenendo così solfato di alluminio come prodotto.
Questo metodo, tuttavia, richiede il riscaldamento del sistema di reazione a circa 100-130°C e la maturazione della miscela di reazione per diverse decine di minuti fino a circa 2 ore. Inoltre, per favorire la reazione, viene e utilizzato acido solforico avente una concentrazione elevata (dal 90 al 98% in peso).
Pertanto si sono ricercati metodi sintetici che utilizzano una temperatura inferiore in un tempo più breve e acido solforico avente una concentrazione inferiore. Si è così ottimizzato un metodo in cui, alla miscela di reazione, viene aggiunto acido nitrico e un perossido e, in particolare, perossido di idrogeno.
Reazioni
Dà luogo a una reazione di decomposizione termica da cui si ottiene anidride solforica e ossido di alluminio:
Al2(SO4)3 → 3 SO3 + Al2O3
A causa della sua solubilità in acqua in cui si liberano ioni Al3+ e SO42-, il solfato di alluminio dà luogo a reazioni di precipitazione. Reagisce infatti con il cloruro di bario secondo una reazione di doppio scambio da cui si ottiene il solfato di bario che, a causa della sua scarsa solubilità, precipita:
Al2(SO4)3(aq) + 3 BaCl2(aq) → 3 BaSO4(s) + 2AlCl3(aq)
In presenza di una base come l’idrossido di sodio dà luogo alla formazione di idrossido di alluminio, scarsamente solubile, che tende a formare un precipitato gelatinoso ed è usato come flocculante:
Al2(SO4)3(aq) + 6 NaOH(aq) → 2 Al(OH)3(s) + 3 Na2SO4(aq)
Analoga reazione di precipitazione in cui si forma l’idrossido di allumino avviene tra il solfato di alluminio e il bicarbonato di sodio da cui si ottengono solfato di sodio e biossido di carbonio:
Al2(SO4)3(aq) + 6 NaHCO3(aq) →2 Al(OH)3(s) + 3 Na2SO4(aq) + 6 CO2(g)
Usi
Uno degli usi più antichi, ma attualmente ancora utilizzato del solfato di alluminio è quello come sostanza mordente per le fibre proteiche come la lana la e seta in quanto si fissa alla fibra permettendo ai coloranti naturali di legarsi ad essa.
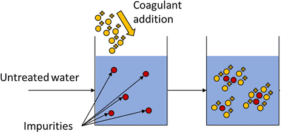
Il solfato di alluminio, unitamente al cloruro di polialluminio al solfato di polialluminio, cloruro di alluminio, cloridrato di alluminio, alluminato di sodio, cloruro di ferro (III) e cloruro di ferro (II) , solfato ferrico e ferroso è uno dei coagulanti maggiormente usati e pertanto utilizzato nel trattamento delle acque e delle acque reflue per la rimozione di piccole particelle e metalli pesanti e la precipitazione di fosfati.

A causa della sua acidità viene aggiunto a terreni molto alcalini per la correzione dei valori di pH e viene usato, in particolare, nella coltivazione delle ortensie che sono particolarmente sensibili al pH per ottenere per ottenere fiori blu, piuttosto che rosa, dove le condizioni del terreno non sono sufficientemente acide.
Il solfato di alluminio viene utilizzato come componente nella produzione della carta poiché modifica le proprietà assorbenti della carta. È inoltre utilizzato dall’industria alimentare quale addensante ed emulsionante ed è l’ingrediente astringente delle matite emostatiche perché elimina il sanguinamento dalle ferite superficiali.



