Legame ionico: esempi, energia reticolare
Il legame ionico, contrariamente al legame covalente, è dovuto alla condivisione di elettroni di legame tra due atomi, è di natura elettrostatica. Legame ionico, covalente e metallico sono i legami più importanti che si verificano nei composti chimici.
Il legame ionico è infatti dovuto all’attrazione tra particelle cariche di segno opposto ed è costituito da cationi e anioni.
I cationi possono essere sia ioni metallici come ad esempio Na+, Ca2+ che ioni poliatomici come ad esempio NH4+.
Gli anioni possono essere sia alogenuri o solfuri come F– e S2- che ioni poliatomici come NO3– o SO42-.
Affinché possano formarsi cationi e anioni è necessario che vi sia una elevata differenza di elettronegatività tra le specie.
Esempio di legame ionico
Consideriamo ad esempio gli elementi litio e fluoro: il litio ha configurazione elettronica 1s2, 2s1 mentre il fluoro ha configurazione elettronica 1s2, 2s2, 2p5.
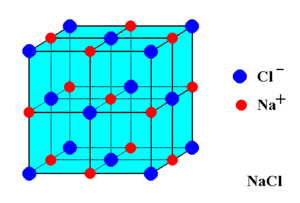
Il litio ha elettronegatività pari a 0.98 mentre il fluoro 3.98; stante l’elevata differenza di elettronegatività il litio perde un elettrone diventando Li+ isoelettronico con il gas nobile elio mentre il fluoro acquista un elettrone diventando F– isoelettronico con il neon.
Si forma così un legame ionico tra queste due specie che si dispongono in un reticolo cristallino che, nella fattispecie, è di tipo cubico a facce centrate.
Un composto ionico è stabile a causa dell’attrazione elettrostatica tra i suoi ioni positivi e negativi.
Energia reticolare
L’energia reticolare di un composto ionico è una misura della forza di questa attrazione ed è definita come l’energia richiesta per separare una mole del solido nei suoi ioni gassosi componenti.
L’energia reticolare di un cristallo ionico può essere espressa dall’equazione:
ΔH = C(Z+)(Z–)/ R0
essendo C una costante che dipende dal tipo di struttura cristallina, Z+ e Z– sono le rispettive cariche degli ioni e R0 è la distanza interionica data dalla somma dei raggi degli ioni positivi e negativi.
Pertanto, l’energia reticolare di un cristallo ionico aumenta rapidamente all’aumentare delle cariche degli ioni e diminuisce quando le dimensioni degli ioni aumentano.
Poiché l’energia reticolare non è sempre misurabile direttamente si può utilizzare il ciclo di Born-Haber. che prende il nome dagli scienziati tedeschi Max Born e Fritz Haber.
I solidi ionici sono duri ma fragili, in genere solubili in acqua e hanno elevate temperature di fusione. Le soluzioni di composti ionici e dei loro sali fusi conducono elettricità.



