Eteropoliacidi: struttura, usi
Gli eteropoliacidi (HPAs) sono degli acidi inorganici forti con ben definite strutture molecolari.
Gli eteropoliacidi sono prodotti condensati costituiti da ossiacidi inorganici di fosforo, silicio, ecc. e da quelli di tungsteno, molibdeno e vanadio.
I metalli anfoteri del gruppo 5 (vanadio, niobio e tantalio) con numero di ossidazione + 5 e del gruppo 6 (cromo, molibdeno e tungsteno) con numero di ossidazione +6, formano acidi deboli che facilmente condensano per formare anioni contenenti diverse molecole dell’anidride acida .

Le anidridi acide possono condensare con altri acidi come acido fosforico o silicico per formare eteropoliacidi.
Le reazioni di condensazione, che avvengono in modo reversibile in soluzione acquosa diluita, comportano la formazione di ponti di ossigeno. Si ha quindi eliminazione dell’acqua da due molecole dell’acido debole.
Esempi sono l’acido fosfotungstico H3PW12O40, acido tungstosilicico H4W12SiO40 e l’acido fosfomolibdico H3PMo12O40
L’acido fosfotungstico e i suoi sali, a causa della loro elevata acidità e conduttività protonica, sono utilizzati nella catalisi organica e nell’elettroanalisi, come materiali di supporto per elettrocatalizzatori e come elettroliti nei sensori. Nel mondo scientifico l’acido fosfotungstico insieme agli altri eteropoliacidi hanno destato particolare interesse in quanto gli acidi solidi sono efficienti e più rispettosi dell’ambiente, ricercati quali catalizzatori eterogenei e utilizzati per le sintesi industriali.
L’acido tungstosilicico, con la sua vasta gamma di applicazioni, ha un ruolo fondamentale nella ricerca scientifica. Questo acido è utilizzato nelle reazioni catalitiche, funge da reagente per la sintesi di composti organici e da catalizzatore per l’ossidazione delle sostanze organiche.
Esso inoltre, contribuisce alla produzione di prodotti farmaceutici e alla produzione di wafer di silicio di elevata purezza. L’acido tungstosilicico trova impiego anche nell’ottenimento di pigmenti, coloranti e vari prodotti industriali.
Al centro della sua versatilità risiede l’attività catalitica dell’acido tungstosilicico in numerose reazioni chimiche. Esso è utilizzato per catalizzare l’ossidazione dei composti organici come, ad esempio, alcoli, aldeidi e chetoni. Inoltre, agevola l’idrolisi di esteri e ammidi, nonché la condensazione di aldeidi e chetoni.
In funzione della loro geometria, sono classificati come Keggin e Wells-Dawson.
Struttura degli eteropoliacidi
Lavorando sotto la supervisione di William Lawrence Bragg presso l’Università di Manchester e sotto l’influenza scientifica di Linus Pauling, il dottor James Fargher Keggin fa pubblicò una scoperta davvero unica: la struttura dell’acido fosfotungstico.
Da allora la struttura di Keggin divenne storicamente rappresentativa di molti eteropolimolibdati ed eteropolitungstati.
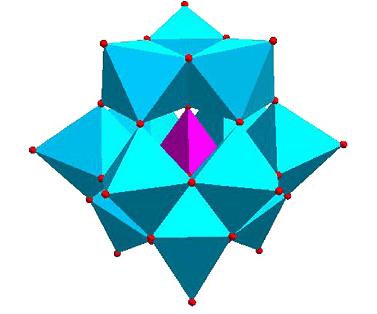
L’unità di Keggin è la struttura primaria degli eteropoliacidi e contiene 12 atomi di metalli di transizione normalmente di tungsteno o molibdeno, un atomo centrale (solitamente fosforo o silicio) e quattro tipi di atomi di ossigeno: ossigeni centrali, ossigeni terminali e due tipi di ossigeni ponte. Ha formula generale [XM12O40]n-dove:
X è un eteroatomo come boro, silicio e fosforo
M è un atomo come molibdeno e tungsteno
Un esempio è costituito dall’anione fosfomolibdato PMo12O403- che è la base dell’acido fosfomolibdico H3 PMo12O40 · 12 H2O che si presenta, in genere, sotto forma dodecaidrata
L’unità di Wells-Dawson è più complessa e ha struttura [X2M18O62]6-
Usi
Gli eteropoliacidi sono usati nella catalisi omogenea ed eterogenea e si utilizzano anche come fotocatalizzatori in sistemi omogene . Essi sono acidi molto forti sia allo stato solido che liquido: ad esempio, le loro soluzioni concentrate hanno un’acidità maggiore dell’acido perclorico o dell’acido solforico.
La forte acidità degli eteropoliacidi li rende adatti come catalizzatori per molte reazioni catalizzate da acidi. Gli HPA sono meno corrosivi e producono una quantità inferiore di sottoprodotti rispetto ai catalizzatori acidi convenzionali, come l’acido solforico. Possono quindi essere utilizzati come sostituti in processi eco-friendly.
In qualità di catalizzatori sono usati nelle reazioni organiche come quelle di ossidazione, riduzione, elettrochimiche, multicomponente e fotochimiche



