Cluster in chimica: atomici, molecolari, metallocarbonilici, zeoball
I cluster in chimica sono raggruppamenti di atomi o molecole legati tra loro per costituire una tipica struttura ‘a grappolo’.
Essi hanno proprietà particolari, intermedie tra quelle di una molecola singola e quelle di un solido.
Contrariamente alle molecole che hanno una stechiometria specifica, la loro composizione può essere alterata da un cambiamento delle condizioni di sintesi.
Essi inoltre tendono a fondersi quando sono avvicinati e spesso possono reagire con i gas presenti nell’ambiente
Frank Albert Cotton utilizzò per primo questo termine all’inizio degli anni ’60 per riferirsi a composti contenenti legami metallo-metallo. In essi sono presenti legami deboli come forze di van der Waals o forti legami ionici.
I cluster possono anche essere costituiti esclusivamente da un certo tipo di molecole, come, ad esempio, i cluster d’acqua.
I principali tipi di cluster sono quelli che contengono leganti come il nicheltetracarbonile e quelli che non contengono leganti come le ferredossine, proteine contenenti cluster ferro-zolfo in grado di mediare il trasferimento di elettroni in numerose reazioni metaboliche.
Per i cluster di metalli di transizione, i leganti tipici includono monossido di carbonio, alogenuri, isocianuri, alcheni e idruri.
I cluster possono contenere fino a diverse centinaia di atomi, ma hanno una disposizione ripetibile e prevedibile a livello atomico. Ed è per questo motivo che hanno proprietà che possono essere utilizzate in modo riproducibile per reazioni chimiche o proprietà ottiche
Classificazione dei cluster in chimica
Atomici
Possono essere puri, formati da una singola specie atomica, o misti e sono classificati secondo:
- il legame predominante metallico, covalente, ionico
- il numero degli atomi
- le proprietà elettriche e magnetiche
L’importanza dei cluster atomici è dovuta alle proprietà davvero uniche, che a volte sono molto diverse da quelle degli atomi costituenti. Ad esempio, cluster di Mn sono dotati di ferromagnetismo mentre il manganese è antiferromagnetico. Sono noti per essere utili come catalizzatori che facilitano diverse reazioni di importanza industriale.
Molecolari
Quelli molecolari in chimica sono classificati sulla base delle forze che li tengono aggregati come cluster:
- di Van der Waals in cui è presente una attrazione tra dipoli elettrici indotti e repulsione tra nuclei di elettroni di configurazioni elettroniche chiuse
- metallici in cui è presente una condivisione di elettroni di valenza a lungo e parzialmente direzionali
- ionici in cui è presente un’attrazione elettrostatica tra particelle cariche di segno opposto
Metallo carbonili
Questi composti metallo carbonili sono specie contenenti due o più metalli, in genere di transizione,
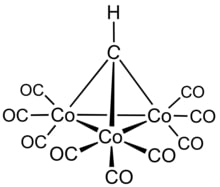
legati a monossido di carbonio come, ad esempio, Fe(CO)6. Vi sono inoltre composti carbonilici anionici come, ad esempio, [Pt3n(CO)6n]2- (n=1-10) denominati Chini cluster in onore del chimico italiano Paolo Chini pioniere nella sintesi di tali tipi di composti. La loro chimica include anche quello di composti metallorganici come [Co3(CH)(CO)9] in cui è presente il gruppo CH
Di alogenuri metallici di transizione
Quelli in cui vi sono alogenuri metallici di transizione sono costituiti in prevalenza da metalli quali: Zr, Hf, Nb, Ta, Mo, W e Re. Alcuni di essi sono stabili alle alte temperature e offrono buone prospettive per l’uso come catalizzatori. Esempi sono K2Re2Cl8 e W4(OCH3)12
Zeoball
Hanno anche strutture esotiche come ad esempio lo zeoball costituito da 192 atomi con formula [Sn36Ge24Se132]24–

È un polianione che rappresenta il più grande cluster discreto conosciuto con un diametro esterno di 2.83 nm. Gli è stato dato questo nome per la sua struttura sferica con pori zeolitici
Così chiamato per la sua struttura e la presenza di pori sferici e zeolitici, il polianione ha un diametro esterno di 2.83 nm, inclusi i raggi di van der Waals degli atomi superficiali.



