Determinazione qualitativa del tiosolfato: test preliminare, test di conferma
Il tiosolfato è utilizzato nelle titolazioni iodometriche in quanto è uno dei pochi agenti riducenti stabili rispetto all’ossidazione dell’aria.
La iodometria è una tecnica analitica quantitativa che si basa sulla ossidazione dello ioduro a iodio e viene usata per la determinazione di agenti ossidanti.
La iodometria utilizza le proprietà ossidanti dello iodio e ha il vantaggio di non essere limitata a determinati valori di pH. Il test iodio-amido fu descritto per la prima volta nel 1814 da Jean-Jacques Colin e Henri-François Gaultier de Claubry e, indipendentemente da Friedrich Stromeyer, nello stesso anno.

La determinazione quantitativa dell’ossidante viene ottenuta tramite titolazione dello iodio con una soluzione standardizzata di tiosolfato di sodio usando la salda d’amido quale indicatore.
La salda d’amido è costituita da amido che contiene due diversi tipi di polisaccaridi costituiti da unità di glucosio legate tra loro in due modi diversi ovvero l’amilosio che è di tipo lineare e l’amilopectina che è di tipo ramificato che forma con lo iodio un complesso di colore blu di colore così intenso che può essere rilevato visivamente quando la concentrazione di iodio è pari a 20 µM a 20 °C.
Test preliminare
Il test preliminare per poter supporre la presenza del tiosolfato in una miscela solida consiste nel mettere una piccola quantità di questa miscela in una provetta e di aggiungere acido cloridrico.
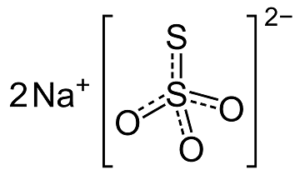
Si noterà la formazione di un precipitato di zolfo e, se la provetta viene riscaldata, l’emissione di anidride solforosa.
La reazione di disproporzione che avviene è la seguente:
S2O32- + 2 H+ → S + SO2 + H2O
Test di conferma del tiosolfato
- Test con l’acetato di piombo
Una soluzione di acetato di piombo è aggiunta alla miscela incognita. La presenza di tiosolfato è confermata dal precipitato bianco di tiosolfato di piombo:
S2O32- + Pb2+ → PbS2O3
A caldo il precipitato diventa nero a causa del solfuro di piombo che si forma secondo la reazione:
PbS2O3 + H2O → PbS + 2 H+ + SO42-
- Test con il cloruro di ferro (III)
Una soluzione di cloruro di ferro (III) è aggiunta alla miscela incognita. La presenza di tiosolfato viene confermata dalla formazione del complesso diamminotiosolfatoferrato (III) di colore viola scuro:
2 S2O32- + Fe3+ → [Fe(S2O3)2]–
La colorazione scompare rapidamente a causa della riduzione del ferro (III) a ferro (II) ad opera del tiosolfato che si trasforma in tetrationato:
2 S2O32- +2 Fe3+ → S4O62- + 2 Fe2+
- Test con il permanganato
In ambiente basico il permanganato reagisce con il tiosolfato per dare un precipitato nero di biossido di manganese e solfato secondo la reazione
F8 MnO4– + 3 S2O32- + H2O → 8 MnO2 + 6 SO42- + 2 OH–
- Test con il nitrato di argento
Una soluzione di nitrato di argento è aggiunta alla miscela incognita per dare un precipitato bianco di tiosolfato di argento secondo la reazione:
S2O32- + 2 Ag+ → Ag2S2O3
Il precipitato in presenza di un eccesso di tiosolfato si solubilizza a causa della formazione del complesso ditiosolfatoargento:
Ag2S2O3 + 3 S2O32- → 2 [Ag(S2O3)2]+
Il tiosolfato di argento tende a decomporsi secondo una reazione di disproporzione con formazione di un precipitato nero di solfuro di argento:
Ag2S2O3 → Ag2S + SO3



