Riduzione dei nitrili ad ammine: reazione, meccanismo
La riduzione dei nitrili porta alla formazione di ammine primarie.
I nitrili sono composti organici di formula R-C≡ N in cui R è un gruppo idrocarburico alifatico o aromatico. L’atomo di carbonio legato all’azoto presenta ibridazione sp e, essendo l’atomo di azoto più elettronegativo rispetto all’atomo di carbonio, quest’ultimo presenta una parziale carica positiva ed è soggetto ad addizioni nucleofile.
Dalla reazione tra un nitrile e un riducente si ottiene un’ammina primaria. La reazione è di riduzione in quanto il carbonio legato all’azoto infatti nei nitrili ha numero di ossidazione +3 mentre nelle ammine come R-CH2-NH2 ha numero di ossidazione -1.
Il riducente che viene usato è il litio alluminio idruro piuttosto che il sodio boroidruro che ha un minore potere riducente pertanto la reazione viene condotta in solventi inerti come dietiletere e tetraidrofurano in quanto in solventi protici il litio alluminioidruro reagisce in modo violento.
In alternativa la reazione può essere realizzata per idrogenazione catalitica utilizzando quali catalizzatori il nichel Raney, il biossido di platino o il boruro di cobalto.
Reazione
La reazione di riduzione può essere schematizzata come:
R-C≡N → R-CH2-NH2
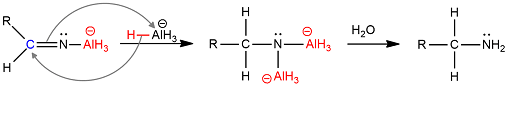
Il litio alluminio idruro ha formula LiAlH4 ed è un forte agente riducente che costituisce un fonte di ioni idruro H– essendo un composto ionico costituito dallo ione Li+ e dall’anione tetraedrico AlH4–.
Meccanismo
La reazione avviene secondo un meccanismo di addizione nucleofila e prevede nel primo stadio della reazione:
- l’addizione di un idruro al carbonio legato all’azoto
- la rottura del triplo legame con formazione di AlH3 e di un azoto carico negativamente che si lega all’alluminio
Nel secondo stadio si ha un’ulteriore addizione di un idruro con rottura del doppio legame carbonio-azoto. Si verifica la formazione di un intermedio che, in presenza di acqua dà luogo all’ammina primaria