Nitrocomposti: proprietà, sintesi, reazioni
I nitrocomposti sono composti organici contenenti il gruppo funzionale nitro –NO2 legato a un atomo di carbonio e costituiscono una classe di composti ampiamente diffusi con elevata reattività e pertanto possono facilmente rappresentare intermedi sintetici per l’inserimento di molti gruppi funzionali.
I nitrocomposti sono denominati con il nome dell’alcano preceduto dal prefisso nitro e con l’indicazione della posizione del nitrogruppo: così CH3NO2 è detto nitrometano e CH3CH(NO2)CH3 è detto 2-nitropropano.
Proprietà dei nitrocomposti
Il nitrogruppo è stabilizzato da due forme limite di risonanza equivalenti in cui l’azoto ha una carica positiva mentre la carica negativa è equamente ripartita tra i due atomi di ossigeno:
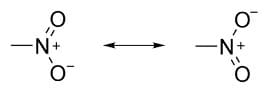
Il nitrogruppo è polare ed è un elettronattrattore sia per effetto induttivo che per effetto di risonanza.
Il gruppo –NO2 presenta una tautomeria simile alla tautomeria cheto-enolica tipica dei composti carbonilici ovvero la tautomeria aci-nitro

Nei nitrocomposti alifatici l’idrogeno in α ha natura acida per l’effetto elettron-attrattore del nitrogruppo e possono essere quindi strappati da una base forte con formazione di un anione che viene sfruttato in molte reazioni.
I nitrocomposti alifatici presenti in natura sono in prevalenza gassosi mentre quelli a peso molecolare più elevato sono liquidi. I nitrocomposti aromatici sono in genere liquidi di colore giallo che con il tempo tendono a scurirsi.
Sintesi
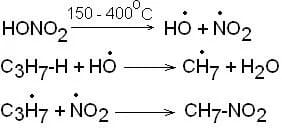
1) Nitrazione di alcani
Gli alcani vengono fatti reagire con una miscela di acido nitrico concentrato. Tale metodo ha una scarsa resa nel caso si tratti di composti alifatici mentre ha una resa maggiore nei composti aromatici. Il meccanismo è di tipo radicalico:
2) Reazione di iodoalcani con nitrito di argento
Questo metodo ha un’alta resa nel caso di composti alifatici mentre ha una bassa resa nel caso di composti aromatici:
CH3CH2I + AgNO2 → CH3CH2NO2 + AgI
3) Ossidazione delle ammine con peracidi ed in particolare con l’acido peracetico e con l’acido trifluorometilperacetico
4) Ossidazione delle ammine terziarie con permanganato di potassio
La reazione avviene in presenza di acido nitrico e di acido solforico per ottenere in situ lo ione nitronio. Tale reazione è un tipico esempio di sostituzione elettrofila aromatica

Il nitrogruppo è un disattivante dell’anello benzenico ed è un meta direttore pertanto la nitrazione del benzene in presenza di acido nitrico fumante dà luogo alla formazione del m-dinitrobenzene.
Reazioni
Le reazioni dei nitrocomposti sono prevalentemente costituite da reazioni di riduzione che vanno studiate separatamente nel caso si tratti di nitrocomposti alifatici o di nitrocomposti aromatici. I nitrocomposti alifatici possono essere ridotti ad alcani per idrogenazione catalitica ad alta temperatura usando il platino quale catalizzatore:
RCH2NO2 → RCH3
In generale le reazioni di riduzione dei nitrocomposti possono essere rappresentate secondo lo schema generale:
R-NO2 → R-N=O → R-NH-OH → R-NH2
Nitrocomposti alifatici
I nitrocomposti alifatici possono essere ridotti ad ammine per reazione con Sn e HCl:
CH3NO2 → CH3NH2
Possono essere ridotti ad idrossilammine per trattamento con diborano:
CH3NO2 → CH3NHOH
I nitrocomposti alifatici possono essere ridotti ad ossime per trattamento con cloruro di stagno (II):
CH3NO2 → CH3-N=OH
Nitrocomposti aromatici
II nitrobenzene viene ridotto ad anilina per reazione con Sn e HCl:
C6H5NO2 → C6H5NH2
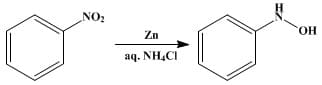
II nitrobenzene viene ridotto a fenil idrossilammina per trattamento con zinco e cloruro di ammonio
In ambiente alcalino, a seconda del reagente riducente, il nitrobenzene dà luogo alla formazione di azobenzene, molecola descritto per la prima volta dal chimico tedesco Eilhard Mitscherlich,per trattamento con lo zinco e alla formazione di azossibenzene per trattamento con As2O3.
I nitrocomposti alifatici primari danno idrossilmammina e acido carbossilico se trattati con acido solforico:
R-CH2NO2 → RCOOH + NH2OH
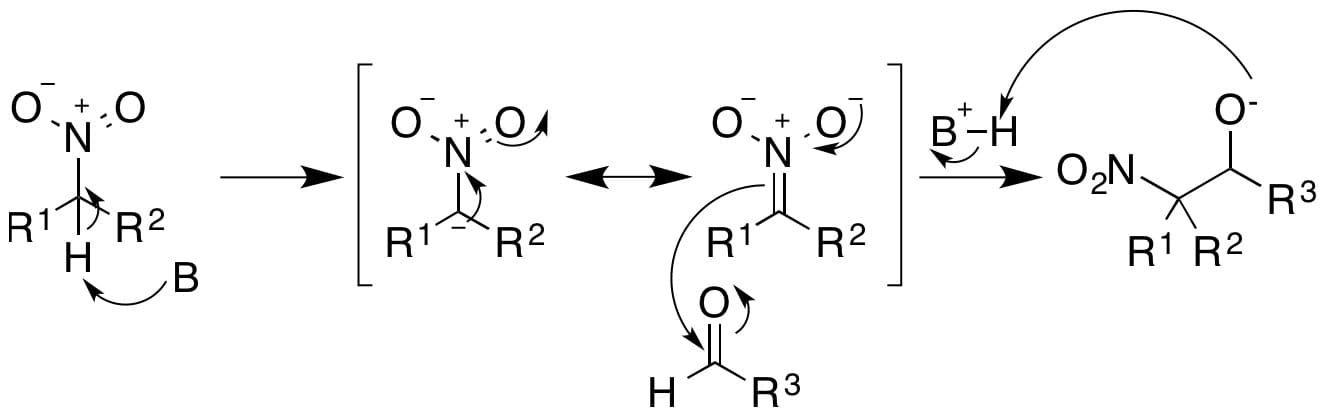
I nitroalcani, in ambiente basico, reagiscono con aldeidi e chetoni dando luogo alla reazione nitroaldolica nota come reazione di Henry in cui si forma un β-nitroalcol.
La reazione inizia con la deprotonazione di un idrogeno in α al nitrogruppo con ottenimento di un intermedio anionico stabilizzato per risonanza che attacca il carbonio carbonilico per dare un alcossido. Quest’ultimo acquista un idrogeno per dare il prodotto di reazione:
I nitroalcani primari e secondari danno luogo alla formazione di composti carbonilici secondo la reazione di Nef: in ambiente basico si ha la deprotonazione di un idrogeno in α al nitrogruppo con ottenimento di un intermedio anionico stabilizzato per risonanza che, trattato con un acido, dà luogo alla formazione di aldeidi o chetoni

I nitrocomposti sono intermedi utili nella preparazione di composti amminici e sali di diazonio, vengono inoltre utilizzati per preparare i coloranti azoici, esplosivi. In particolare il nitrobenzene è il precursore di prodotti chimici di gomma, pesticidi, coloranti, esplosivi e prodotti farmaceutici ed in particolare per la produzione di paracetamolo



