Reazioni biocatalitiche di ossidazione
Le reazioni biocatalitiche di ossidazione hanno trovato numerose applicazioni in vari campi in alternativa alla catalisi chimica. Storicamente, le reazioni di ossidazione, anche su scala industriale, utilizzano sali di cromo e manganese ad alto numero di ossidazione che portano a quantità di rifiuti non rispettosi dell’ambiente.
Negli ultimi decenni, l’attenzione della ricerca si è spostata verso ossidanti come l’acqua ossigenata e l’ozono che producono rispettivamente acqua e ossigeno molecolare come sottoprodotti che sono verdi e sostenibili per la natura. Gli enzimi si aggiungono ai catalizzatori organici e a quelli costituiti da metalli di transizione e stanno guadagnando interesse per realizzare reazioni biocatalitiche di ossidazione selettive.
L’uso di enzimi nella sintesi organica, in particolare nella produzione di composti chirali utilizzati nei prodotti farmaceutici e nell’industria degli aromi e delle fragranze, sono gli esempi più importanti. Gli enzimi sono i catalizzatori preferiti nelle reazioni biocatalitiche di ossidazione per la loro elevata selettività e offrono approcci ispirati alla natura per la sintesi chimica sostenibile.
Gli enzimi ossidativi come, ad esempio, la monoossigenasi, la perossigenasi, l’ossidasi e la deidrogenasi, costituisco i catalizzatori più tipici nelle reazioni biocatalitiche di ossidazione. In generale le ossidoreduttasi consentono trasformazioni altamente selettive ed efficienti in condizioni blande che vanno dalle semplici ossidazioni di alcol alle alogenazioni stereoselettive di legami carbonio-idrogeno non attivati. Le condizioni di reazione generalmente molto blande possono anche ridurre l’impatto ambientale delle reazioni biocatalitiche di ossidazione.
Classificazione delle reazioni biocatalitiche di ossidazione
Le reazioni biocatalitiche di ossidazione possono essere classificate in reazioni di deidrogenazione e reazioni di funzionalizzazione ossidativa. Le reazioni di deidrogenazione implicano tipicamente l’ossidazione di alcoli o ammine rispettivamente a chetoni e immine e le ossidazioni delle aldeidi portano ai corrispondenti acidi carbossilici.
I riducenti liberati in queste trasformazioni vengono trasferiti ai cofattori della nicotinammide (deidrogenasi) o all’ossigeno molecolare (ossidasi). Le reazioni di funzionalizzazione ossidativa sono tradizionalmente catalizzate dalle monoossigenasi. Questi enzimi attivano riduttivamente l’ossigeno molecolare: un atomo di ossigeno viene inserito nel materiale di partenza mentre l’altro atomo di ossigeno viene utilizzato per formare acqua come prodotto finale.
Più recentemente, le perossigenasi aspecifiche (UPO) stanno ricevendo un crescente interesse come alternative alle monoossigenasi. Le UPO, a differenza delle monoossigenasi, utilizzano direttamente ossigeno parzialmente ridotto sotto forma di perossido di idrogeno. Le perossigenasi aspecifiche descritte per la prima volta nel basidiomicete Agrocybe aegerita catalizzano naturalmente un’ampia gamma di reazioni biocatalitiche di ossidazione utilizzando il perossido di idrogeno come accettore di elettroni e quindi possiedono un grande potenziale applicativo.
L’utilizzo di enzimi in forma purificata o inseriti in sistemi cellulari per la produzione di molecole organiche è adottato in diversi campi industriali come quello chimico, farmaceutico, alimentare, cosmetico e tessile.
Enzimi nella deidrogenazione
Gli enzimi tipicamente utilizzati nelle reazioni biocatalitiche di ossidazione per la deidrogenazione sono l’alcol deidrogenasi che catalizza la reazione che avviene nel citosol alcol + NAD⁺ ⇄ aldeide o chetone + NADH + H⁺ e l’immina reduttasi che riduce le immine in ammine. Questi enzimi mediano il trasferimento reversibile di un idruro da un atomo di carbonio di alcol o ammina al cofattore della nicotinammide.
Gli enzimi flavina-dipendenti catalizzano un’ampia varietà di reazioni biologiche importanti per tutti i tipi di organismi viventi utilizzando una porzione flavinica legata all’enzima, generalmente la flavina adenina dinucleotide come accettore primario di idruro. Le ammine ossidasi delle flavoproteine catalizzano l’ossidazione di diverse ammine primarie, secondarie o terziarie attraverso la riduzione del loro cofattore flavinico.

Altri enzimi utilizzati nelle reazioni biocatalitiche di ossidazione sono le amminoossidasi di rame (CAO) che contengono Cu2+ e un cofattore chinone derivato dalla tirosina che catalizzano la conversione di un gruppo funzionale amminico primario in un’aldeide e generano perossido di idrogeno e ammoniaca come sottoprodotti. In particolare la galattosio ossidasi catalizza la reazione: D-galattosio + O₂ ⇄ D-galatto-esodialdoso + H₂O₂ utilizzando il rame come cofattore.
Le laccasi sono ossidasi rame-dipendenti, che riducono l’ossigeno molecolare in acqua e sono presenti nelle piante, nei funghi e nei batteri e permettono loro di degradare la lignina. Catalizzano la riduzione di quattro elettroni dell’ossigeno in acqua e, dopo l’adsorbimento sulla superficie di un elettrodo, è riducono l’ossigeno a sovrapotenziali inferiori rispetto ai migliori elettrocatalizzatori di metalli nobili normalmente utilizzati.
Enzimi nelle reazioni di funzionalizzazione ossidativa
Gli enzimi tipicamente utilizzati nelle reazioni biocatalitiche di ossidazione nelle reazioni di funzionalizzazione ossidativa sono le ossigenasi che catalizzano l’inserimento selettivo dell’ossigeno nei legami C−H, C−C e C=C, generando così nuovi gruppi funzionali. Questi enzimi si distinguono in diossigenasi che catalizzano l’incorporazione di due atomi di ossigeno molecolare per substrato e monoossigenasi che incorporano un atomo di ossigeno molecolare per substrato mentre l’altro atomo viene ridotto ad acqua.

La monoossigenasi contenente flavina è un enzima che catalizza un’ampia gamma di reazioni di epossidazione, idrossilazione e alogenazione di areni attivati, ossigenazioni eteroatomiche e ossidazioni Baeyer-Villiger.
Le monoossigenasi eme-dipendenti in grado di sono catalizzatori di dar luogo a una funzionalizzazione ossidativa e sono in grado di agire anche sui legami C−H non attivati. In particolare i citocromi P450 sono presenti in batteri, funghi, piante e mammiferi contenenti il gruppo eme sono coinvolti in diverse vie metaboliche come la sintesi di vitamine, di ormoni steroidei e la detossificazione di xenobiotici.
Nell’ambito delle reazioni biocatalitiche di ossidazione questi enzimi oltre a catalizzare la monossigenazione di atomi di carbonio non reattivi, ma sono anche in grado di catalizzare l’epossidazione di doppi legami carbonio-carbonio, la deamminazione, la dealogenazione, l’idrossilazione di anelli aromatici e la dealchilazione.
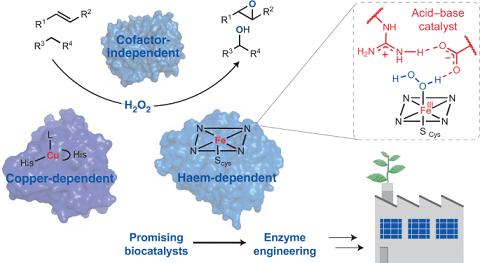
Le perossigenasi sono una nuova classe emergente di enzimi che consente reazioni di funzionalizzazione ossidativa selettiva in modo indipendente dal cofattore diverso dalle monoossigenasi P450 agendo in condizioni blande e richiedendo perossido di idrogeno come fonte di ossigeno. Sono in grado di inserire ossigeno nel legame C-H non attivato sia nei composti alifatici che aromatici. L’unico requisito catalitico della perossigenasi è il perossido di idrogeno, che agisce sia come accettore finale di elettroni che come donatore di ossigeno.
Pur mostrando una chimica simile alle monoossigenasi P450 nelle reazioni di funzionalizzazione ossidativa le perossigenasi richiedono molti meno requisiti per catalizzare complesse reazioni chimiche di funzionalizzazione ossidativa con elevata efficienza, in assenza di costosi cofattori redox o flavoproteine ausiliarie, essendo enzimi altamente attivi e secreti extracellulari.



