Eteri corona
Gli eteri corona sono una molecole organiche contenenti idrogeno, carbonio e ossigeno: nella struttura della molecola, di tipo ciclico, ogni atomo di ossigeno è legato a due atomi di carbonio e disposti ad anello. Gli eteri corona sono degli oligomeri dell’ossido di etilene che presentano l’unità ripetitiva –CH2-CH2-O-
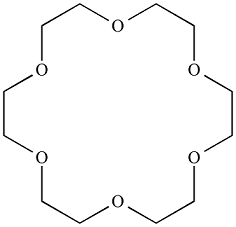
Nel 1960 il chimico della DuPont Charles Pedersen scoprì una molecola in grado di portare in soluzioni organiche ioni di metalli alcalini. Pubblicò la sua scoperta sugli eteri policiclici nel 1967 descrivendone la sintesi. Il primo etere corona sintetizzato è il 18-corona-6
Nella nomenclatura degli eteri corona il:
- primo numero si riferisce al numero di atomi presenti nella struttura ciclica
- secondo numero si riferisce al numero di atomi di ossigeno presenti.
Proprietà degli eteri corona
Hanno particolari caratteristiche in quanto presentano una cavità interna della molecola che è una regione polare stante la presenza dei doppietti elettronici solitari presenti sugli atomi di ossigeno ed inoltre essa ha una dimensione paragonabile al diametro di ioni di metalli alcalini che possono essere solvatati.
La superficie esterna degli eteri corona è apolare e quindi sia gli eteri corona che i loro complessi con ioni di metalli alcalini sono solubili in solventi organici apolari.
A seconda della dimensione della cavità interna gli eteri corona presentano specificità quali chelanti per gli ioni dei metalli alcalini:
- 18-corona-6 è in grado di chelare lo ione K+
- 15-corona-5 avente dimensioni minori chela lo ione Na+
- il più piccolo il 12-corona-4 chela il più piccolo degli ioni alcalini Li+.
Sintesi
Possono essere ottenuti da una reazione di ciclizzazione di tipo SN2: ad esempio il 18-corona-6 può essere ottenuto a partire dal glicole trietilenico.

Una metodologia sintetica prevede una reazione il cui l’idrossido di potassio agisce come base per deprotonare i gruppi HO- dei dioli, creando atomi di ossigeno nucleofili che spostano gli atomi di cloro dai carboni primari degli 1,2-dicloroetani.
In laboratorio sono usati per la loro caratteristica di essere catalizzatori per trasferimento di fase. Essi sono catalizzatori che accelerano la migrazione di reagenti in un sistema eterogeneo da una fase ad un’altra dove può avvenire la reazione. I reagenti ionici sono in genere solubili in solventi polari ma sono insolubili in fase organica fin quando non si usa un tale tipo di catalizzatore.



