Monossido di azoto: proprietà, sintesi, reazioni, usi
Il monossido di azoto noto come ossido nitrico ha formula NO ed è uno dei principali ossidi dell’azoto. identificato per la prima volta come gas dal chimico inglese Joseph Priestly nel 1772
Nel monossido di azoto è presente un doppio legame azoto-ossigeno ma, mentre l’ossigeno completa il suo ottetto atomico, l’azoto presenta un elettrone spaiato e pertanto la molecola viene considerata come un radicale libero.
La molecola, a meno di un elettrone è elettronicamente equivalente a N2 ed è pertanto paramagnetica.
Secondo la teoria degli orbitali molecolari l’elettrone spaiato si trova nell’orbitale π* e l’ordine di legame tra i due atomi è di 2.5 piuttosto che 3 come si verifica nella molecola di azoto.
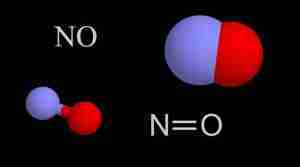
La lunghezza di legame tra azoto e ossigeno è di 1.15 Å che è un valore intermedio tra la distanza di legame presente nello ione nitrosonio NO+ pari a 1.06 Å in cui è presente un triplo legame e la tipica distanza di un doppio legame che è di 1.20 Å.
È pertanto facile ossidare l’ossido nitrico in cui l’azoto ha numero di ossidazione +2 a ione nitrosonio in cui l’azoto ha numero di ossidazione +3:
NO → NO+ + 1 e–
Sintesi del monossido di azoto

Nel corpo umano il monossido di azoto viene prodotto nel corso del ciclo dell’urea a partire da ossigeno e arginina che viene trasformata in citrullina grazie all’azione dell’enzima ossido nitrico sintasi appartenente alla classe delle ossidoreduttasi che catalizza la reazione
L-arginina + n NaDPH + n H+ + m O2 ⇄ citrullina + ossido nitrico + NADP+
L’ossido nitrico viene immesso nell’atmosfera a partire dagli elementi azoto e ossigeno ad opera della reazione di sintesi:
N2(g) + O2(g) → 2 NO(g)
La reazione avviene in presenza di fulmini o nei motori a combustione interna.
In laboratorio l’ossido nitrico può essere, tra l’altro ottenuto, dalla reazione tra rame e acido nitrico:
3 Cu(s) + 8 HNO3(s)→ 3 Cu(NO3)2(aq) + 2 NO(g) + 4 H2O(l)
Reazioni del monossido di azoto
L’ossido nitrico può dare una reazione di decomposizione trasformandosi in azoto e ossigeno:
2 NO(g) → N2(g) + O2(g)
L’ossido nitrico può dimerizzare secondo una reazione di equilibrio:
2 NO(g) → N2O2(g)
A caldo dà una reazione di disproporzione trasformandosi in monossido di diazoto e biossido di azoto:
3 NO(g) → N2O(g) + NO2(g)
L’ossido nitrico reagisce con:
- l’idrogeno per dare azoto e vapore acqueo secondo la reazione:
2 NO(g) + 2 H2(g) → N2(g) + 2 H2O(g)
- il cloro per dare cloruro di nitrosile secondo la reazione:
2 NO(g) + Cl2(g) → 2NOCl (g)
Analoga reazione avviene con il fluoro e il bromo
- l’ossigeno per dare biossido di azoto:
2 NO(g) + O2(g) → 2 NO2(g)
- ossigeno e acqua per dare acido nitroso:
4 NO + O2 + 2 H2O → 4 HNO2
- con l’ozono per dare biossido di azoto e ossigeno
NO + O3 → NO2 + O2
Tale reazione contribuisce all’assottigliamento dello strato di ozono.
L’ossido nitrico, unitamente agli altri ossidi dell’azoto NOx viene emesso dai gas di scarico dei veicoli e dalla combustione di carbone, petrolio, gasolio e gas naturale e in particolare dalle centrali elettriche creando rischi per la salute ambientale in quanto reagisce con la luce solare e altre sostanze chimiche per formare lo smog.
Usi
L’ossido nitrico controlla la circolazione del sangue e regola il rilascio di ormoni e neurotrasmettitori, come l’adrenalina pertanto vi sono integratori a base dei suoi precursori arginina e citrullina che vengono assunti specialmente dagli sportivi.
L’ossido nitrico agisce rilassando la muscolatura liscia e agisce da vasodilatatore polmonare selettivo e viene pertanto somministrato per inalazione a pazienti con problemi respiratori.



