Spettroscopia Raman
La spettroscopia Raman è una tecnica di analisi chimica non distruttiva che fornisce informazioni dettagliate su struttura chimica, fase e polimorfismo, cristallinità e interazioni molecolari e utilizzata per eseguire controlli di qualità, identificazione dei campioni, caratterizzazione dei materiali e in generale per indagare sulle proprietà fisiche e chimiche.
La spettroscopia Raman si basa sul fenomeno di diffusione di una radiazione elettromagnetica monocromatica da parte del campione analizzato. La spettroscopia Raman prende il nome dal fisico indiano Chandrasekhara Venkata Raman che fu il primo a osservare in fenomeno della diffusione della luce nel 1928 e vincitore del Premio Nobel per la Fisica nel 1930.
La spettroscopia Raman è una tecnica di diffusione della luce, in base alla quale una molecola disperde la luce incidente da una sorgente di luce laser ad alta intensità. La maggior parte della luce diffusa ha la stessa lunghezza d’onda della sorgente laser e non fornisce informazioni utili. Tuttavia, una piccola quantità di luce, ovvero circa 1 fotone su 10 milioni, viene diffusa a diverse lunghezze d’onda, che dipendono dalla struttura chimica dell’analita.

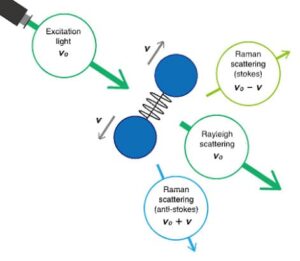
L’ onda elettromagnetica che colpisce una molecola può essere trasmessa, assorbita e diffusa e se la collisione è elastica, la frequenza della radiazione diffusa è uguale a quella della radiazione incidente (diffusione Rayleigh).
Se la collisione è anelastica, la frequenza della radiazione diffusa è superiore o inferiore a quella della radiazione incidente (diffusione o effetto Raman). Nell’effetto Raman i fotoni della radiazione interagiscono con la molecola e l’energia dei fotoni diffusi è aumentata o diminuita rispetto a quella dei fotoni incidenti di incrementi quantizzati che corrispondono alle differenze energetiche tra i livelli rotazionali o vibrazionali della molecola.
Linea Stokes e linea anti-Stokes
Quando un fotone con energia hν0 interagisce con la molecola possono verificarsi due casi:
1) la frequenza della radiazione incidente è adatta a provocare una eccitazione elettronica e la molecola passa quindi a occupare uno stato stazionario (assorbimento elettronico)
2) la frequenza della radiazione non è adatta a produrre un assorbimento elettronico e la molecola passa ad occupare uno stato instabile che non è stazionario. In questo caso la molecola non può rimanere in questo stato per lungo tempo e quindi diffonde energia.
Se il fotone diffuso ha la stessa energia del fotone di eccitazione si origina la diffusione Rayleigh. Se, però, la molecola invece di ritornare allo stato vibrazionale eccitato ν = 0 cede energia fino a raggiungere lo stato vibrazionale eccitato ν = 1 l’energia del fotone della radiazione diffusa è uguale a:
hν0 – hν1 = h (νo – ν1)
essendo ν1 la frequenza di vibrazione relativa alla transizione ν= 0 → ν= 1.
Nello spettro della radiazione diffusa compare la linea Raman chiamata linea Stokes che hanno una lunghezza d’onda più lunga della lunghezza d’onda della radiazione eccitante che è responsabile della fluorescenza o dell’effetto Raman
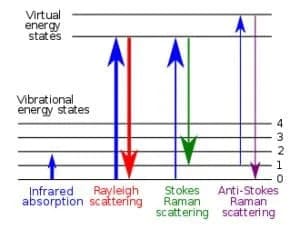
Si può verificare anche che la molecola, inizialmente nel livello vibrazionale eccitato ν= 1, passi allo stato instabile con energia hν0 + hν1 e per diffusione ritorni al livello ν= 0. In questo caso il fotone della radiazione diffusa ha energia:
hν0 + hν1 = h (ν0 + ν1)
e la linea spettrale ha lunghezza d’onda inferiore e frequenza maggiore della radiazione incidente (linea anti-Stokes).
In un insieme di molecole, la maggior parte delle molecole si troverà al livello vibrazionale fondamentale (distribuzione di Boltzmann) e lo scattering di Stokes è il processo statisticamente più probabile. Di conseguenza, lo scattering Raman di Stokes è sempre più intenso dell’anti-Stokes e per questo motivo è quasi sempre lo scattering Raman di Stokes quello che viene misurato nella spettroscopia Raman.
Principio della spettroscopia Raman
A differenza della spettroscopia infrarossa a trasformata di Fourier che esamina i cambiamenti nei momenti di dipolo, la spettroscopia Raman esamina i cambiamenti nella polarizzabilità dei legami molecolari. Quando la luce viene diffusa dalla molecola, il campo elettromagnetico oscillante di un fotone infatti induce una polarizzazione della nuvola di elettroni molecolari che lascia la molecola in uno stato energetico più elevato poiché l’energia del fotone trasferita alla molecola.
I legami molecolari hanno transizioni energetiche specifiche in cui si verifica un cambiamento di polarizzabilità, ad esempio, le molecole che contengono legami tra atomi uguali come i legami carbonio-carbonio, zolfo-zolfo e azoto-azoto subiscono un cambiamento nella polarizzabilità quando i fotoni interagiscono con loro.
La spettroscopia Raman misura il divario energetico tra i livelli vibrazionali della molecola. La scala dei livelli vibrazionali riguarda un singolo modo vibrazionale della molecola. Le molecole poliatomiche conterranno molti modi vibrazionali, ciascuno con la propria scala di livelli vibrazionali.
Per le molecole non lineari con atomi di N, il numero di modi vibrazionali è dato da 3N-6 dove 3N sono i gradi di libertà totali della molecola a cui vengono poi sottratti i 3 gradi di libertà traslazionali e 3 rotazionali, il che lascia 3N – 6 modi vibrazionali. Per le molecole lineari esiste un grado di libertà rotazionale in meno e il numero di modi vibrazionali è quindi 3N-5.
Non tutte le modalità vibrazionali possono essere rilevate utilizzando la spettroscopia Raman. Affinché una modalità vibrazionale possa essere misurata, deve essere “Raman Active” che si verifica quando la polarizzabilità molecolare cambia durante la vibrazione.



