Reazioni dell’ozono con composti organici e inorganici
Le reazioni dell’ozono sono incentrate sull’instabilità della molecola e sul suo elevato potere ossidante. Il potenziale normale di riduzione dell’ozono relativo alla semireazione di riduzione:
O3 + 2 H+ + 2 e– → O2 + H2O
è pari a E° = + 2.07 V ed è quindi molto elevato
Inoltre dalla decomposizione dell’ozono in acqua si ottengono radicali idrossilici che sono a loro volta energici ossidanti
Reazioni dell’ozono con composti inorganici
Reagisce con iodio in presenza di tetracloruro di carbonio a – 78°C per dare nonossido di tetraiodio e ossigeno
2 I2 + 9 O3 → I4O9 + 9 O2
ioduro di potassio per dare idrossido di potassio, iodio e ossigeno
KI + O3 → KOH + I2 + O2
solfuro di piombo per dare solfato di piombo e ossigeno:
PbS + O3 → PbSO4 + O2
Reazioni dell’ozono con i metalli
Dalle reazioni dell’ozono con i metalli si ottiene l’ossido metallico e ossigeno:
2 Hg + O3 → Hg2O+ O2
2 Ag + O3 → Ag2O+ O2
Cu + O3 → CuO + O2
Reazioni con composti dell’azoto
Reagisce con gli ossidi dell’azoto
In presenza di ossido nitrico dà luogo alla formazione di biossido di azoto:
NO + O3 → NO2 + O2
Reagisce con il biossido di azoto per dare triossido di azoto:
NO2 + O3 → NO3 + O2
In presenza di ammoniaca dà luogo alla formazione di nitrato di ammonio
2 NH3 + 4 O3 → NH4NO3 + 4 O2 + H2O
Decontaminazione delle acque

L’ozono, insufflato da appositi generatori, è in grado di uccidere agenti patogeni e impurità come virus, batteri e ossidare i metalli. Gli ossidi metallici sono allontanati tramite filtrazione meccanica.
Reazioni dell’ozono con composti organici
Reagisce con gli alcheni tramite un processo denominato ozonolisi
L’ozonolisi di un alchene comporta la rottura sia del legame σ che del legame π presenti nel doppio legame con formazione di due gruppi carbonilici.
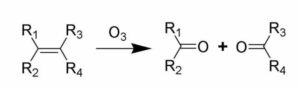
Si ha la formazione di due frammenti contenenti il gruppo carbonile. L’ozonolisi di un alchene è una tecnica sfruttata per individuare la posizione del doppio legame in un alchene.
Analogamente agli alcheni anche gli alchini danno ozonolisi per dare anidridi o dichetoni. Se è presente acqua nella reazione, l’anidride idrolizza per dare due acidi carbossilici




