Reazione di Simmons-Smith: meccanismo, prodotti di reazione
La reazione di Simmons-Smith comporta la ciclopropanazione di alcheni tramite un reattivo alometilzinco abitualmente I-CH2-Zn-I
Simmons e Smith, chimici della DuPont, nel 1958 scoprirono che il reattivo ottenuto dalla coppia zinco– rame con diiodiometano CH2I2 in etere poteva essere usato per la conversione stereospecifica degli alcheni a ciclopropani.
Attualmente la ciclopropanazione di Simmons-Smith è una delle reazioni organiche più usate per convertire un’olefina in derivati del ciclopropano a causa delle stereospecificità della reazione rispetto al doppio legame e alla sua compatibilità con un elevato numero di gruppi funzionali.
L’ottenimento del carbenoide metallico avviene secondo la reazione:
I-CH2-I → I-CH2-Zn ⇄ I-CH2-Zn-I
Carbenoidi
I carbenoidi possono essere divisi in due categorie:
1) quelli che hanno formula generale MCH2X
2) quelli che hanno formula generale M=CH2. Nella reazione di ciclopropanazione vengono usati i carbenoidi della prima specie in cui M = Zn, Sm o Al sebbene altri metalli come Cu, Cd e Hg sono stati utilizzati nella reazione di alcune olefine
La reazione tra un alchene e il carbenoide è una reazione chelotropica, sottoclasse delle cicloaddizioni. Una reazione chelotropica è un tipo di reazione periciclica ovvero una reazione che ha uno stato di transizione in cui in una matrice ciclica di atomi avviene una riorganizzazione di orbitali σ e π.
La ciclopropanazione è una reazione concertata in cui lo stato di transizione è di tipo a “farfalla”.
Meccanismo della reazione di Simmons-Smith
La schema generale di una reazione di Simmons-Smith è il seguente:
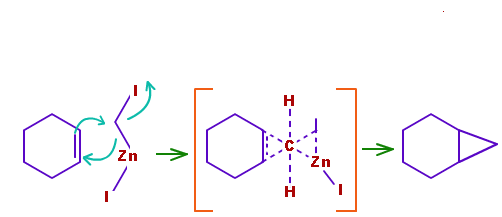
e il meccanismo di reazione tra il cicloesene e il carbenoide per dare il biciclo[4.1.0]eptano è illustrato in figura:
in cui si può notare che entrambi i nuovi legami C-C si formano simultaneamente. Si può considerare che l’attacco nucleofilo del doppio legame C=C porti all’allontanamento del gruppo uscente ioduro e gli elettroni del legame C-Zn siano usati per formare l’altro legame C-C.