Ione arenio
Lo ione arenio è un intermedio di reazione stabilizzato per risonanza che si forma a seguito di un attacco elettrofilo sull’anello aromatico. Il meccanismo più ampiamente accettato di sostituzione elettrofila aromatica è di tipo bimolecolare e coinvolge lo ione arenio quale intermedio.
La sostituzione elettrofila aromatica è un processo che avviene in due stadi: nel primo stadio l’addizione di un elettrofilo spesso generato in situ dà luogo alla formazione di uno ione arenio, detto intermedio di Wheland che prende il nome dal chimico statunitense George Willard Wheland in cui è presente un carbonio appartenente all’anello benzenico carico positivamente stabilizzato per risonanza.
Lo ione arenio è un intermedio cationico cicloesadienilico detto complesso σ dotato di un’alta energia in quanto non è più presente il sistema π del benzene in cui l’elettrofilo è legato a un carbonio tramite legame σ.
Sostituzione elettrofila aromatica
Le reazioni di sostituzione elettrofila aromatica come nitrazione, solfonazione, alchilazione e acilazione di Friedel-Crafts avvengono per sostituzione di un atomo di idrogeno con un elettrofilo. Sebbene gli elettroni π delocalizzati negli anelli aromatici siano molto meno reattivi di quelli presenti negli alcheni isolati o coniugati, possono subire reazioni elettrofile.
Il benzene non dà generalmente un’addizione elettrofila ai doppi legami aromatici perché ciò sarebbe energeticamente sfavorevole in quanto comporterebbe una perdita di aromaticità nel prodotto della reazione che non rispetterebbe la regola di Hückel che prende il nome dal fisico e chimico tedesco Erich Hückel.
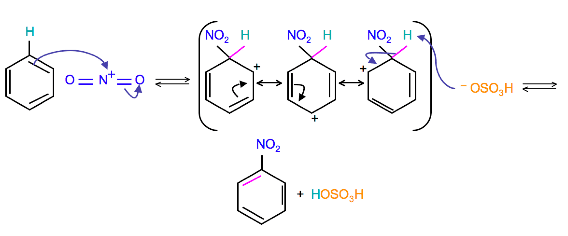
Indipendentemente dall’elettrofilo utilizzato il meccanismo generale della sostituzione elettrofila aromatica si compone solitamente di tre stadi. Nel primo stadio si ha la formazione dell’elettrofilo. Ad esempio nella nitrazione del benzene avviene un attacco elettrofilo da parte dello ione nitronio NO2+ che viene generato in situ mescolando assieme l’acido nitrico e l’acido solforico concentrato.
L’acido solforico, essendo un acido molto forte nella prima dissociazione protona l’acido nitrico dando luogo alla formazione di H2NO3+. Quest’ultimo perde acqua per dare lo ione nitronio. La reazione che avviene è:
HNO3 + H2SO4 ⇌ HSO4– + H2NO3+
H2NO3+ ⇌ H2O + NO2+

Nel secondo stadio della reazione gli elettroni π del benzene attaccano l’elettrofilo che prende due elettroni del sistema aromatico a sei elettroni con formazione dello ione arenio che presenta un legame σ tra un atomo di carbonio dell’anello benzenico e l’elettrofilo.
Nel caso della nitrazione del benzene lo ione nitronio si lega all’anello benzenico per dare lo ione arenio in a causa della rottura di uno dei tre doppi legami del benzene reca una carica positiva all’interno dello stesso.
Nel terzo stadio della sostituzione elettrofila aromatica l’idrogeno presente sul carbonio che ha un’ibridazione sp3 dello ione arenio viene rimosso da un nucleofilo che ripristina l’aromaticità dell’anello. Nel caso della nitrazione del benzene il nucleofilo che può essere costituito da H2O, HSO4– o NO3–, rimuove l’idrogeno legato allo stesso carbonio cui si è legato il nitro gruppo con formazione rispettivamente di H3O+, H2SO4 o HNO3.
Risonanza dello ione arenio
Lo ione arenio gode di stabilizzazione per risonanza e ha, nelle forme di risonanza più importanti, una carica positiva localizzata nella posizione orto o nella posizione para rispetto all’elettrofilo. Nello ione arenio, il carbonio legato all’elettrofilo è ibridato sp3 e, quindi, non può far parte del sistema di legami π coniugati.
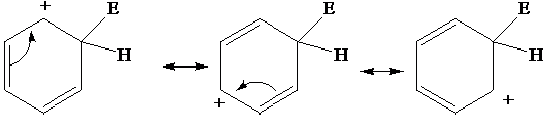
Pertanto lo ione arenio, se da un lato è stabilizzato per risonanza, dall’altro non è uno ione aromatico. La sua formazione è energeticamente sfavorevole in quanto vi è una perdita dell’aromaticità e pertanto è lo stadio lento della reazione che ne determina la velocità.
È un carbocatione secondario in cui sono presenti due doppi legami coniugati , che a loro volta sono coniugati con l’orbitale p vuoto del carbonio caricato positivamente. Lo ione arenio presenta tre strutture limite di risonanza, in cui la carica positiva appare su tre atomi di carbonio.



