Acido tartarico: struttura, sintesi, usi
L’acido tartarico è un acido bicarbossilico avente formula HOOC-CH(OH)-CH(OH)-COOH il cui nome I.U.P.A.C. è acido 2,3-diidrossibutandioico e può essere considerato come il derivato ossidrilato in posizione 2 e 3 dell’acido succinico.
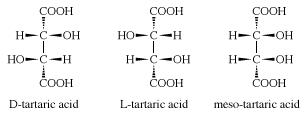
Struttura dell’acido tartarico
Presenta due atomi di carbonio asimmetrici e pertanto ha due enantiomeri l’acido D-(S,S)-(−)-tartarico, l’acido L-(R,R)-(+)-tartarico e l’acido (2R,3S)-tartarico che è lo stereoisomero meso.
Gli studi sulle sue proprietà cristallografiche, chimiche e ottiche compiute dal chimico e biologo Louis Pasteur posero le basi alla stereoisomeria.
L’acido e i suoi sali, a temperatura ambiente, sono solidi cristallini bianchi solubili in acqua. In origine era estratto dal tamarindo e utilizzato per i suoi effetti benefici sull’apparato digerente in quanto migliora l’assorbimento intestinale. Tuttora, miscelato a bicarbonato di sodio, è usato nella preparazione di digestivi effervescenti.
 Esso è contenuto in alte concentrazioni nell’uva, albicocche, avocado, mirtilli, banane, fichi d’India, mele e nei semi di girasole.
Esso è contenuto in alte concentrazioni nell’uva, albicocche, avocado, mirtilli, banane, fichi d’India, mele e nei semi di girasole.
Nonostante la sua ampia diffusione in natura, solo nel 1769 il chimico svedese Carl Wilhelm Scheele ottenne tale composto.
Fece bollire il bitartrato di potassio con solfato di calcio e trattando il prodotto con acido solforico. In natura è presente sotto forma di acido D- il primo ad essere conosciuto, il più diffuso, detto anche perciò acido tartarico ordinario.
Sintesi
Può essere ottenuto per ossidazione del glucosio in presenza di acido nitrico ed enzimi come la perossidasi; l’acido nitrico può esplicare la sua azione ossidante anche nei confronti del lattosio e dell’amido.
Un altro metodo di sintesi consiste nell’elettrolisi acida dell’acido saccarico o, in alternativa, dal trattamento dello stesso acido saccarico con un perossido come il perossido di idrogeno o il perossido di bario.
L’acido tartarico è ottenuto comunemente quale sottoprodotto dei processi enologici; la presenza di acido tartarico è rinvenuta sia nelle vinacce spremute che nel vino dopo la fermentazione principale.
Nel corso della fermentazione lenta dal vino si separano altri materiali tartarici sia nelle fecce che nei depositi che si formano sulle pareti delle botti detti tartari di botte. Questi ultimi, unitamente alle vinacce e alle fecce costituiscono le materie prime dei prodotti tartarici destinati al consumo.
L’acido tartarico che rimane nel vino conferisce la sensazione di freschezza, mentre un vino che ha una carenza di acido tartarico appare senza corpo.
Reazioni
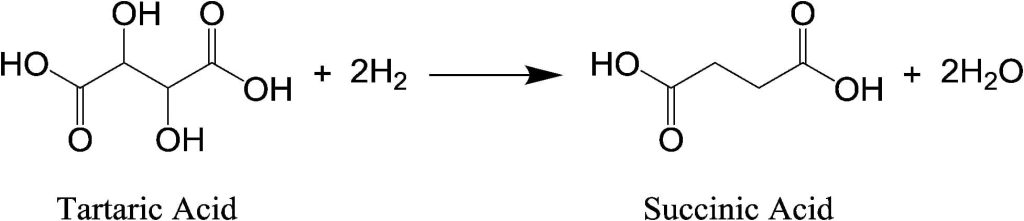
In atmosfera di idrogeno e in presenza di un catalizzatore di ossido di molibdeno supportato su nero di carbonio e acido bromidrico in acido acetico avviene la scissione selettiva dei legami C – O dell’acido tartarico e l’idrogenazione selettiva dei carboni insaturi risultanti con formazione di acido succinico.
A seguito di riscaldamento si decompone in acido piruvico con sviluppo di biossido di carbonio
Usi
È usato principalmente nell’industria alimentare come acidificante e conservante nei succhi di frutta, conserve, bevande analcoliche e nelle marmellate e nel campo enologico come correttore di acidità.
In campo farmaceutico l’acido tartarico è utilizzato nella preparazione di granulati effervescenti in combinazione con l’acido citrico per migliorare il sapore dei farmaci.
Come molti α-idrossiacidi, ha proprietà esfolianti e stimola il rinnovamento cellulare conferendo alla pelle un aspetto fresco, compatto e luminoso. Pertanto è usato nella formulazione di prodotti cosmetici.
Esso è utilizzato, da solo o in associazione con altri α-idrossiacidi per la formulazione di:
- prodotti schiarenti
- antimacchia
- anti acne
- nel trattamento di pelli impure, asfittiche e inspessite.
In edilizia l’acido tartarico è usato per preparare il gesso utilizzato su pareti e pannelli prefabbricati.: aggiunto al gesso, ne rallenta la presa rendendolo più facile da distribuire.
In campo industriale è usato per la pulizia e la lucidatura metalli, nella tintura della lana, e in alcuni processi di stampa e sviluppo fotografico