Superbasi inorganiche, organiche e organometalliche
Le superbasi sono composti che hanno una particolare affinità per i protoni e possono essere inorganiche, organiche e organometalliche. Il chimico Manfred Schlosser fu uno dei pionieri nella ricerca su questi composti ottenendo la base di Schlosser costituita, generalmente da n -butillitio e potassio terz -butossido
Sebbene la I.U.P.A.C. definisca superbase una specie con elevata basicità come il litio diisopropilammide spesso si considera l’idrossido di sodio come base di riferimento come l’acido solforico è l’acido di riferimento dei superacidi.
Secondo un altro criterio si considera una superbase una specie che ha una basicità maggiore rispetto all’ 1,8-bis(dimetilammino)naftalene. La loro scoperta risale a circa 60 anni fa e dal allora sono state largamente utilizzate
Superbasi inorganiche
Le superbasi inorganiche sono sali con ioni negativi di piccole dimensioni altamente carichi come, ad esempio, il nitruro di litio Li3N che ha un’estrema densità di carica negativa e quindi è fortemente attratto dagli acidi, come lo ione idronio acquoso.
Altri esempi sono gli idruri di metalli alcalini e alcalino-terrosi come idruro di sodio NaH e idruro di calcio CaH2
Superbasi organiche
Contengono, nella gran parte dei casi, azoto che, grazie al suo doppietto elettronico solitario agisce da base secondo Brønsted-Lowry.
Un esempio è costituito dai fosfazeni, composti organici del fosforo, caratterizzati da un doppio legame tra azoto e fosforo che ha numero di ossidazione V.
Un altro esempio sono i fosfani derivanti dalla fosfina PH3 che è un idruro di fosforo che hanno formula generale PH3-nRn come P(CH2CH2Z)3 dove Z = -NO2, -CN e -C(O)NH2
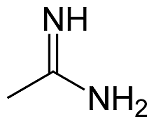
Vi sono poi le ammidine caratterizzate dal gruppo funzionale
In esse lo ione protonato presenta due strutture equivalenti in cui vi è un azoto caricato positivamente:
Tra le superbasi organiche vi è la guanidina avente formula HNC(NH2)2 che ha un pKb pari a 0.4 e pertanto in soluzione acquosa è presente prevalentemente come ione guanidinio. Infatti l’equilibrio
HNC(NH2)2 + H2O ⇄ C(NH2)3+ + OH–
a causa dell’elevato valore di pKb è spostato a destra
Superbasi organometalliche
Sono tipicamente costituite da composti organici del litio RLi o da alcossidi di metalli alcalini come ROM dove M = Na, K, Rb, Cs. Tra essi il litio diisopropilammide [(CH3)2CH]2NLi comunemente utilizzato in chimica organica per deprotonare acidi deboli.
Usi
Le superbasi sono catalizzatori eccezionali in molte reazioni e loro sali hanno un’ottima stabilità chimica ed elettrochimica e sono promettenti come fonti di energia elettrochimica. Sono utilizzate in reazioni di metallazione in situ di opportuni substrati per ottenere composti organometallici