Il boro è presente in natura sotto forma di borati nella kernite Na2B4O7· 4 H2O, nel borace Na2B4O7· 10 H2O e nella colemanite Ca2B6O11· 5 H2O; sotto forma di acido borico è presente in molte forme di vulcanesimo secondario come i soffioni boraciferi di Larderello.
Preparazione
Il boro si ottiene dall’ossido per riduzione con magnesio secondo la reazione:
B2O3 + 3 Mg → 3 MgO + 2 B
Si ottiene così in forma amorfa, impura e bruna, utile tuttavia a usi tecnologici. Viene usato come additivo per acciai e per le barre di controllo dei reattori nucleari.
Il boro puro, difficile da preparare viene ottenuto in piccole quantità per pirolisi dello ioduro o per riduzione del bromuro con idrogeno a elevate temperature e con particolari accorgimenti:
2 BBr3 + 3 H2 → 2 B + 6 HBr
Proprietà del boro
E’ di colore nero e particolarmente duro (durezza 9 nella scala di Mohs) altofondente, refrattario e semiconduttore; sono note varie modificazioni cristalline (forme polimorfe) le tre fasi solide che si riesce ad ottenere in forma cristallina contengono unità icosaedriche B12 (costituite da 20 facce triangolari) impacchettate in maniera compatta o quasi compatta e tenute assieme da legami covalenti tra i poliedri.
Per quanto attiene la reattività bisogna distinguere tra le forme impure, che sono notevolmente reattive, e l’elemento puro che è particolarmente inerte.
Non è attaccato da acidi non ossidanti e molto lentamente dagli ossidanti in generale. Dal punto di vista chimico il boro è un non metallo e presenta più analogie con la chimica del silicio che non con quella dell’alluminio. In tabella vengono riportate alcune grandezze chimico-fisiche del boro.
|
Nome |
Boro |
|
Simbolo |
B |
|
5 |
|
|
Peso atomico |
10.81 |
|
Configurazione elettronica |
1s2, 2s2, 2p1 |
|
Potenziale di I ionizzazione (eV) |
8.30 |
|
Potenziale di II ionizzazione (eV) |
25.15 |
|
Potenziale di III ionizzazione (eV) |
37.92 |
|
Forma cristallina |
romboedrico |
|
Raggio metallico |
0.98 Å |
|
Raggio ionico B3+ |
0.20 Å |
|
Potenziale normale redox B3+/B |
-0.73 V |
|
Punto di fusione |
2177 °C |
|
Punto di ebollizione |
3658 °C |
|
Densità |
2.35 g/cm3 |
|
Elettronegatività |
2.04 (Pauling) |
|
Abbondanza (% in peso) |
1 ∙10-3 |
Composti
Boruri
Il boro si combina con la maggior parte degli elementi o direttamente o in altro modo, riducendo, per esempio gli ossidi metallici con miscele di carbone e carburo di boro. I composti ottenuti vengono detti genericamente boruri, ma si ottengono una grande varietà di stechiometrie e di tipi strutturali.
I rapporti di combinazione metalli-boro variano in un intervallo molto ampio fra M4B e MB12 e i tipi di struttura sono legati a tali rapporti.
Un composto interessante è il nitruro di boro BN che esiste in due modificazioni allotropiche: quella stabile a basse temperature ha una struttura tipo grafite mentre quella ottenuta a temperature e pressioni elevate ha una struttura tipo diamante ed è più dura del diamante stesso.
Alogenuri
Sono noti tutti i trialogenuri di boro BF3, BCl3, BBr3, BI3, composti molecolari e monomeri a geometria triangolare planare in cui si suppone la presenza di legame π fra gli orbitali pieni dell’alogeno e quello vuoto sul boro. L’alogenuro più importante è BF3 che può essere ottenuto secondo la reazione:
B2O3 + 3 CaF2 + 3 H2SO4 → 2 BF3 + 3 CaSO4 + 3 H2O
E’ un gas incolore (temperatura di ebollizione – 101 °C); si scioglie in acqua da cui cristallizzano due idrati, BF3 · H2O e BF3 · 2 H2O .
E’ un forte acido di Lewis e coordina una molecola donatrice per formare l’addotto tetraedrico BF3L. Può coordinare acqua, alcoli, ammine e altre basi e un altro atomo di fluoro per formare lo ione tetrafluoroborato BF4–.
Idruri
La struttura e la reattività chimica dei borani sono dipendenti dal fatto che il boro possiede tre elettroni spaiati da impiegare nella formazione dei legami a quattro orbitali in cui allocarli.
L’idruro più semplice è BH3 o borano. Nel legarsi a tre atomi di idrogeno al boro rimane un orbitale p vuoto. Tale insaturazione rende la molecola molto reattiva: il borano, infatti dimerizza con facilità diventando diborano B2H6 la cui struttura è costituita da due atomi di idrogeno centrali che distribuiscono la coppia elettronica di legame tra entrambi gli atomi di boro così da formare un legame a tre centri come è evidenziato in figura:
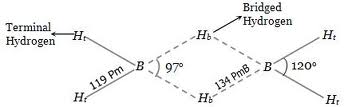
Il diborano è un gas che si infiamma facilmente in aria e si idrolizza rapidamente in acqua. Per trattamento termico, fra i 100 °C e i 200 °C subisce una serie di trasformazioni strutturali dando luogo a borani superiori.
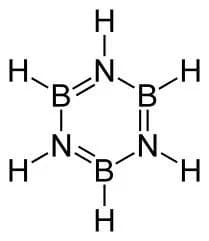
Strutturalmente connessi ai borani e ai loro anioni sono i carborani, composti poliedrici nel cui scheletro un atomo o più atomi di boro sono sostituiti da carbonio. Un altro composto del boro è il borazene B3N3H6 isoelettronico e isostrutturale con il benzene, anch’esso rappresentabile da strutture di risonanza.
Composti ossigenati
Il composto ossigenato più importante è il triossido B2O3 molto solubile in acqua in cui dà acido borico H3BO3 che è un acido monobasico molto debole e poco solubile in acqua fredda; si comporta come accettore di ossidrili e non come donatore di protoni:
H3BO3 + 2 H2O ⇌ [B(OH)4]– + H3O+
Esistono numerosi anioni dell’acido borico di cui non sempre esiste l’acido libero che danno luogo a strutture per alcuni versi simili a quelle dei silicati: ortoborati contenenti l’anione planare BO32-, piroborati contenenti l’anione dimero B2O54-, metaborati contenenti l’anione ciclico B3O63-, metaborati polimeri contenenti catene estese (BO2)nn-
