Bisolfito di sodio
Il bisolfito di sodio è un composto chimico che ha formula NaHSO3 in cui lo zolfo presenta numero di ossidazione +4 e spesso usato come blando agente riducente e utilizzato come additivo alimentare ad azione antiossidante per preservare la freschezza e il colore delle verdure e dei succhi, in particolare di quelle verdi. Come additivo alimentare è indicato con il numero E E222
Deriva formalmente dall’acido solforoso per sostituzione di un idrogeno con il sodio e in acqua si dissocia in Na+ e HSO3–. Lo ione bisolfito agisce da acido dando la sua base coniugata ovvero lo ione solfito secondo l’equilibrio:
HSO3– + H2O ⇄ H3O+ + SO32- regolato da una costante pari a Ka2 = 6.73 · 10-8

Le soluzioni di bisolfito di sodio hanno reazione acida infatti HSO3– è la base coniugata di H2SO3 che ha un valore di Ka1 piuttosto alto e pari a 1.7 ·10−2 e pertanto il primo equilibrio di dissociazione è spostato verso destra. Pertanto lo ione bisolfito si comporta da acido debole e di conseguenza cede protoni all’acqua e le sue soluzioni sono acide.
Il bisolfito di sodio si presenta sotto forma di cristalli bianchi, dall’odore caratteristico di zolfo, dal sapore sgradevole, solubile in acqua, poco solubile in etanolo, instabile all’aria e non combustibile.
Sintesi del bisolfito di sodio
Le soluzioni di bisolfito di sodio possono essere preparate facendo reagire l’anidride solforosa in una soluzione alcalina contenente, ad esempio, idrossido di sodio o bicarbonato di sodio secondo le reazioni:
SO2 + NaOH → NaHSO3
SO2 + NaHCO3 → NaHSO3 + CO2
Tuttavia la cristallizzazione per ottenere il bisolfito di sodio allo stato solido non porta alla formazione del prodotto desiderato ma al metabisolfito Na2S2O5. A seguito di dissoluzione in acqua si rigenera il bisolfito di sodio:
Na2S2O5 + H2O → 2 Na+ + 2 HSO3−
Reazioni
Il bisolfito di sodio si ossida lentamente all’aria per dare bisolfato di sodio secondo la reazione:
2 NaHSO3 + O2 → 2 NaHSO4
Alla temperatura di 315 °C dà luogo a decomposizione termica con formazione di ossido di sodio, vapore acqueo e anidride solforosa:
2 NaHSO3 → Na2O + H2O + 2 SO2
In presenza di perossido di idrogeno dà luogo a una reazione di ossidoriduzione per dare solfato di sodio, acido solforico e acqua:
2 NaHSO3 + 2 H2O2 → Na2SO4 + H2SO4 + 2 H2O
Nella reazione lo zolfo si ossida passando da numero di ossidazione +4 a + 6 e l’ossigeno del perossido si riduce passando da numero di ossidazione -1 a -2.
Reagisce sia con gli acidi che con le basi. La reazione con acido cloridrico porta alla formazione di cloruro di sodio, acqua e anidride solforosa:
NaHSO3 + HCl → NaCl + H2O + SO2
La reazione con idrossido di sodio dà luogo alla formazione di solfito di sodio e acqua:
NaHSO3 + NaOH → Na2SO3 + H2O
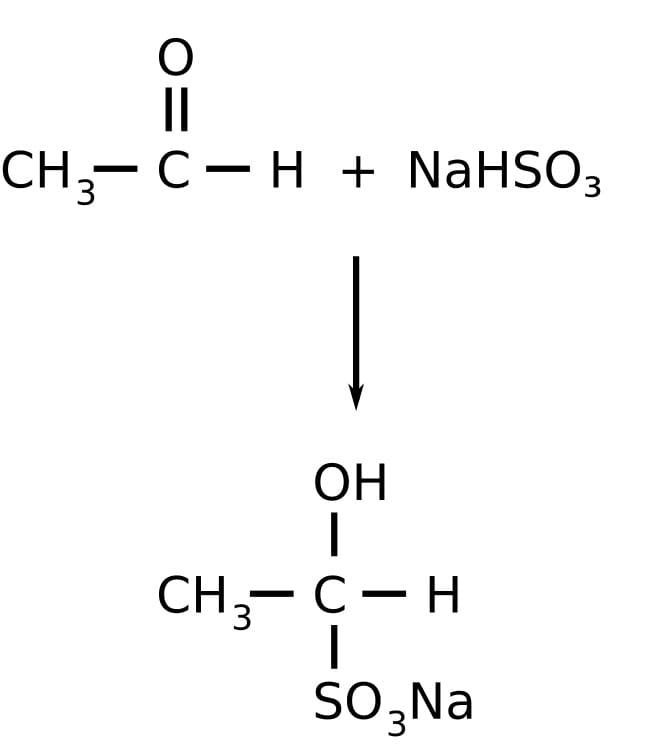
Le aldeidi reagiscono con il bisolfito di sodio per dare prodotti di addizione mentre i chetoni, ad eccezione dei metilchetoni, non reagiscono a causa dell’ingombro sterico. Questa reazione è utilizzata come test, nell’ambito della chimica qualitativa organica, per distinguere le aldeidi dai chetoni. Infatti gli addotti che si formano con le aldeidi sono solidi cristallini. La reazione è anche utilizzata per separare le aldeidi dai chetoni
Il bisolfito di sodio reagisce con acido ipocloroso secondo una reazione di ossidoriduzione per dare solfato acido solforico acido cloridrico e solfato di sodio
2 NaHSO3 + 2 HClO → H2SO4 + 2 HCl + Na2SO4
Usi
È ampiamente utilizzato nell’industria chimica come antiossidante, agente riducente e sbiancante. È usato nel trattamento delle acque reflue contenenti cloro e dei rifiuti dell’industria conciaria e galvanica. Il bisolfito di sodio al 25% è utilizzato nella sintesi di composti, nella purificazione di aldeidi e chetoni, per la produzione di derivati solfonati, pesticidi e erbicidi.

Nella frutta secca e nelle marmellate agisce per evitare l’imbrunimento enzimatico causato dalla polifenolossidasi. È usato nel trattamento dell’acqua di caldaia per evitare la presenza di ossigeno e per ridurre la presenza di metalli.
Il bisolfito di sodio viene utilizzato come alternativa economica ai comuni agenti riducenti, principalmente nelle formulazioni di biscotti e cracker. Può essere utilizzato nella preparazione di biscotti grazie alle sue proprietà condizionanti dell’impasto. Se utilizzato nei prodotti da forno, il bisolfito di sodio migliora l’uniformità di cracker e biscotti riducendo il ritiro e inibendo l’eccessiva doratura. Inoltre inibisce la crescita dei batteri in condizioni di pH elevato e agisce da antiossidante ritardando l’ossidazione e l’irrancidimento



