Acido esafluorosilicico: sintesi, reazioni, usi
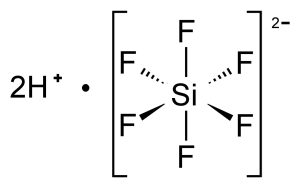
L’acido esafluorosilicico è un composto inorganico ha formula H2SiF6 e si presenta come un liquido incolore che emette fumi dall’odore pungente
Sintesi dell’acido esafluorosilicico
Può essere preparato in una reazione a due stadi:
nel primo stadio vengono fatti reagire biossido di silicio e acido fluoridrico con ottenimento di tetrafluoruro di silicio:
SiO2 + 4 HF→ SiF4+ 2 H2O
Dalla reazione tra tetrafluoruro di silicio e acqua si ottiene l’acido esafluorosilicico
3 SiF4+ 2 H2O → 2 H2SiF6 + SiO2
Reazioni
L’acido esafluorosilicico reagisce:
- in acqua per dare acido fluoridrico e acido ortosilicico
H2SiF6 + 4 H2O → 6 HF+ Si(OH)4
- con il cloruro di sodio per dare esafluorosilicato di sodio e acido cloridrico:
H2SiF6 + 2 NaCl → Na2SiF6 + 2 HCl
- con l’idrossido di sodio per dare esafluorosilicato di sodio e cloruro di sodio
H2SiF6 + 2 NaOH → Na2SiF6 + 2 NaCl
- con i cianuri per dare esafluorosilicato e cianuro di idrogeno:
H2SiF6 + 2 CN– → SiF62- + 2 HCN
Si decompone in presenza di acido solforico concentrato per dare tetrafluoruro di silicio e fluoruro di idrogeno
H2SiF6 → SiF4 + 2 HF
Usi
L’acido esafluorosilicico in presenza di ossido di alluminio dà luogo alla formazione di biossido di silicio e fluoruro di alluminio che viene utilizzato per la produzione di alluminio per via elettrolitica.
L’acido esafluorosilicico è utilizzato nella fluorurazione delle acque. Ne è stato vietato l’uso come biocida dalla Commissione europea a causa della mancanza di dati tossicologici per dimostrare che era sicuro per l’uomo e l’ambiente
È inoltre utilizzato insieme all’acido ossalico nei prodotti per la pulizia della ruggine.
Il fluorosilicato di potassio è usato per la produzione della porcellana mentre quello di magnesio per il calcestruzzo.



