Scelta di un indicatore nelle titolazioni acido-base
La scelta di un indicatore nelle titolazioni è di fondamentale importanza per la determinazione del punto finale.
Nelle titolazioni acido-base si utilizzano degli indicatori che variano la loro colorazione in funzione del pH come ad esempio il metilarancio che varia il colore nell’intervallo di pH tra 3 e 4.5 o la fenolftaleina che varia il colore nell’intervallo tra 8.3 e 10. Pertanto la scelta dell’indicatore è dettata dal pH del punto equivalente.
Se una soluzione contenente metilarancio è rossa il suo pH è inferiore a 3, se è arancione il pH è compreso tra 3.2 e 4.4 mentre è gialla se il pH è superiore a 4.4.
Se una soluzione contenente fenolftaleina è incolore il suo pH è inferiore a 8.2 mentre a valori di pH maggiori di 9.8 è di colore rosso porpora.
Vengono qui considerati solo questi due indicatori ma il ragionamento può essere esteso anche ad altri indicatori acido-base.
Equilibrio
Si consideri un generico indicatore HIn il quale, essendo un acido debole si dissocia secondo l’equilibrio:
HIn ⇌ H+ + In–
Tale equilibrio è regolato da una costante di dissociazione indicata con Kin la cui espressione è:
Kin =[ H+][ In–] /[HIn]
A metà del punto equivalente si verifica che [In–] = [HIn]
Pertanto Kin =[ H+] ovvero pKin = pH
Il punto finale per l’indicatore dipende quindi dal valore di pKin che nel caso del metilarancio vale 3.7 e nel caso della fenolftaleina vale 9.3.
Gli indicatori non variano bruscamente il loro colore a un dato pH ma in un intervallo di pH e la variazione avviene tra un pH maggiore o minore di una unità rispetto al valore di pKin.
Occorre pertanto scegliere un indicatore che viri in prossimità del pH al punto equivalente.
Viraggio
Si consideri dapprima una titolazione acido forte-base forte in cui il punto equivalente si verifica ad un valore di pH pari a 7 a cui non vira nessuno degli indicatori.
Tuttavia, analizzando il grafico relativo alla titolazione acido forte base forte si può notare che a pH pari a 7 la curva è così ripida che non vi è alcuna differenza nel volume di acido aggiunto a prescindere dall’indicatore scelto.

Tuttavia è opportuno utilizzare la fenolftaleina che inizia il viraggio a pH pari a 8.3 che è il più vicino possibile al punto equivalente.
Nel caso di una titolazione acido forte base debole, come si può vedere dal grafico, il punto equivalente si verifica a valori acidi di pH
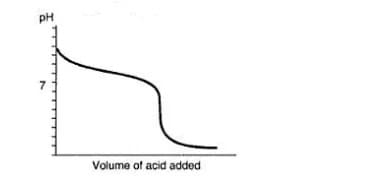
Pertanto la fenolftaleina non è l’indicatore adatto mentre il metilarancio risulta essere un buon indicatore.
Nel caso di una titolazione base debole-acido forte, come si può vedere dal grafico, il punto equivalente si verifica a valori di pH maggiori di 7
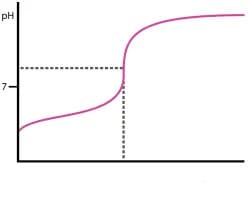
Pertanto il metilarancio non è l’indicatore adatto mentre la fenolftaleina risulta essere un buon indicatore.



