Blu timolo
La timolsulfonftaleina nota come blu timolo è un indicatore acido-base e pertanto utilizzato nelle titolazioni. Si presenta sotto forma di polvere cristallina di colore verde-brunastro o bruno-rossastro poco solubile in acqua ma solubile in etanolo e in soluzioni di alcali diluiti.
Per le sue proprietà il blu timolo è utilizzato quale componente dell’indicatore universale che è un indicatore di pH costituito vari indicatori acido-base in una proporzione fissa mostrando un cambiamento di colore graduale quando il pH della soluzione cambia da 0 a 14. I componenti dell’indicatore universale sono, oltre al blu timolo, il rosso metile, il blu di bromotimolo e la fenolftaleina.
Per preparare una soluzione di blu timolo, da utilizzare quale indicatore, si pesano accuratamente 0.1 g di blu di timolo e si versano in un matraccio tarato da 100 mL contenente 2.15 mL di soluzione di idrossido di sodio 0.05 M e 5.00 mL di etanolo al 95%. Dopo aver scaldato la soluzione si aggiungono 25.00 mL di etanolo al 95% e si diluisce a 100 mL con acqua distillata. La concentrazione della soluzione preparata è di circa 1 g/L.
Indicatori acido-base e blu timolo
Gli indicatori acido-base sono acidi o basi organiche deboli la cui forma acida ha un colore diverso da quello della forma basica coniugata. Con il termine indicatore si intende un composto in grado di subire modifiche facilmente osservabili – di solito il colore – in funzione dell’ambiente chimico in cui si trova.
Indicando con HIn un generico indicatore, questo, a contatto con l’acqua si dissocia secondo l’equilibrio che,
HIn + H2O ⇌ H3O+ + In–
in cui, secondo la teoria di Brønsted-Lowry dovuta al chimico danese Johannes Nicolaus Brønsted e al chimico britannico Thomas Martin Lowry, In–è la base coniugata di HIn
Sia Kin la costante di dissociazione del generico indicatore HIn. L’espressione della costante di equilibrio è:
Kin = [H3O+][In–]/ [HIn] da cui: Kin/ [H3O+] = [In–]/ [HIn]
Quando la concentrazione dello ione H3O+ ha lo stesso valore numerico di Kin il rapporto tra [HIn] e [I–] è uguale a 1 e quindi il 50% dell’indicatore è presente nella forma acida mentre il 50% è presente nella forma basica.
Dall’ultima equazione si vede che sia la forma acida che quella basica sono presenti a qualsiasi valore di pH, ma l’occhio umano è in grado di percepire solo il colore della forma prevalente. La scelta di un indicatore nelle titolazioni è di fondamentale importanza per la determinazione del punto finale.

Nelle titolazioni acido-base si utilizzano degli indicatori che variano la loro colorazione in funzione del pH come ad esempio il metilarancio che varia il colore nell’intervallo di pH tra 3 e 4.5 o la fenolftaleina che varia il colore nell’intervallo tra 8.3 e 10.
Pertanto la scelta dell’indicatore è dettata dal pH del punto equivalente. Se una soluzione contenente metilarancio è rossa il suo pH è inferiore a 3, se è arancione il pH è compreso tra 3.2 e 4.4 mentre è gialla se il pH è superiore a 4.4. Se una soluzione contenente fenolftaleina è incolore il suo pH è inferiore a 8.2 mentre a valori di pH maggiori di 9.8 è di colore rosso porpora.
Viraggi del blu timolo
Contrariamente agli altri indicatori il blu timolo mostra due viraggi. Esso infatti può essere considerato come un acido diprotico ed ha quindi due valori di Ka. Il primo valore di Ka che può essere indicato come KIn1 è pari a 0.0316 cui corrisponde un pKIn1 di 1.5 e un conseguente intervallo di viraggio di pH da 1.2 a 2.8.
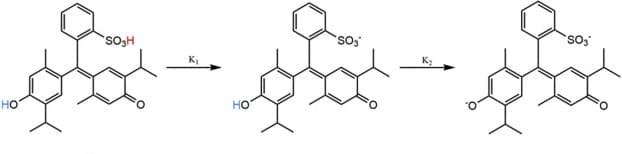
Al di sotto di 1.2 le soluzioni contenenti blu timolo hanno colore rosso mentre al di sopra di 2.8 hanno colore giallo. Il secondo valore di Ka che può essere indicato come KIn2 è pari a 1.26 · 10-9 cui corrisponde un pKIn2 di 8.9 e un conseguente intervallo di viraggio di pH da 8.0 a 9.6. Al di sotto di 8.0 le soluzioni contenenti blu timolo hanno colore giallo mentre al di sopra di 2.8 hanno colore blu.

Per verificare sperimentalmente questi dati si possono preparare soluzioni a pH determinato nell’intervallo 0–14 e utilizzarle per misurare le curve di distribuzione o grafici di speciazione. Tali curve, per un acido, sono grafici che riportano le frazioni molari o le concentrazioni relative percentuali delle diverse specie presenti in soluzione in funzione del pH.
Tramite spettrofotometria visibile e ultravioletta si raccolgono gli spettri di assorbanza di tutte le soluzioni contenenti blu timolo per ottenere la curva di distribuzione del blu di timolo confrontando i dati ottenuti con quelli tabulati.



