Determinazione del calcio
La determinazione del calcio presente nell’acqua può essere ottenuta per via complessometrica utilizzando come titolante l’EDTA. Tuttavia per la determinazione del calcio si procede in modo diverso rispetto alla determinazione del calcio e del magnesio che costituiscono la durezza totale.
L’EDTA ovvero l’acido etilendiamminotetracetico, sintetizzato per la prima volta dal chimico austriaco Ferdinand Münz, è un acido poliammino carbossilico solubile in acqua dotato di due doppietti elettronici appartenenti all’azoto.
La sua base coniugata è l’etilendiamminotetracetato. E’ un agente chelante esadentato ovvero ha la capacità di “sequestrare” ioni metallici bivalenti quali Ca2+, Mg2+ presenti in un’acqua oltre a Fe3+ e Al3+. Nella determinazione del calcio e del magnesio interferiscono quindi tutti gli altri cationi bivalenti, che però nelle acque naturali in genere sono presenti in concentrazioni molto basse.
In una tipica determinazione analitica l’EDTA, al fine di complessare uno ione metallico si deve presentare sotto forma di Y4- e ciò avviene a un valore di pH pari a 10 e pertanto si utilizza una soluzione tampone ammoniacale.
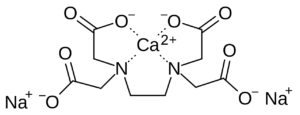
La formazione del complesso metallo-EDTA con lo ione Ca2+ può essere rappresentato dall’equilibrio:
Ca2+ + Y4- ⇄ CaY2-
per il quale la costante di equilibrio, detta costante di formazione, Kf la cui espressione è:
Kf = [CaY2-]/ [Ca2+][ Y4-]
vale 4.90 · 1010. Questo valore elevato indica che il complesso è stabile e l’equilibrio è spostato verso destra.
Pertanto, nella determinazione del calcio, in assenza di magnesio, si può procedere utilizzando l’EDTA preventivamente standardizzato e il nero eriocromo T quale indicatore metallocromico fino al viraggio da rosso ad azzurro con scomparsa dei riflessi viola.
Per la standardizzazione dell’EDTA si prepara dapprima una soluzione a titolo approssimato 0.01 M che è la concentrazione più idonea alla determinazione del calcio e del magnesio contenuto nell’acqua e poi si standardizza con uno standard primario che, abitualmente, è costituito da carbonato di calcio preventivamente solubilizzato con acido cloridrico
Determinazione della durezza dell’acqua
Operando nelle condizioni dette, dopo la standardizzazione dell’EDTA con il carbonato di calcio, si determina la durezza totale di un campione di acqua che, per convenzione, è espressa in ppm di carbonato di calcio, ignorando il contributo dovuto ai sali di magnesio.

Dato che la massa molecolare di CaCO3 è pari a circa 100 g/mol una durezza di 1000 ppm corrisponde ad una concentrazione totale di calcio e magnesio di 0.01 M.
Supponendo che 50.00 mL di una soluzione richiedano 25.55 mL di una soluzione di EDTA 0.0149 M per calcolare la concentrazione dello ione Ca2+ in termini di ppm di CaCO3 si procede con i seguenti calcoli:
0.0149 mol EDTA/L ∙ 0.02555 L ( 1 mol EDTA/ 1 mol Ca2+) = 0.000381 mol Ca2+
0.000381 mol Ca2+ ( 1 mol CaCO/ 1 mol Ca2+) ( 100.09 g CaCO3/ 1 mol CaCO3) = 0.0381 g CaCO3
ppm CaCO3 = mg CaCO3/ L (soluzione) = 38.1 mg/ 0.02500 L = 762
Volendo esprimere la durezza dell’acqua in gradi francesi °F si può utilizzare la seguente formula:
°F = mLEDTA · MEDTA · MMCaCO3 · 100/mLCamp
Dove mLEDTA è il volume di EDTA necessario per raggiungere il punto finale, MEDTA è la molarità dell’ acido etilendiamminotetracetico, MMCaCO3 è la massa molecolare di CaCO3 pari a 100.0869 g/mol e mLCamp è il volume del campione di acqua analizzata.
Determinazione del calcio in presenza di magnesio
Se si vuole procedere alla determinazione del calcio in presenza di magnesio si deve considerare che la formazione del complesso magnesio-EDTA che può essere rappresentato dall’equilibrio:
Mg2+ + Y4- ⇄ MgY2-
per il quale la costante di equilibrio, detta costante di formazione, Kf la cui espressione è:
Kf = [MgY2-]/ [Mg2+][ Y4-]
vale 6.17 · 108. Questo valore elevato indica che il complesso è stabile e l’equilibrio è spostato verso destra.
Pertanto per la determinazione del calcio in presenza di magnesio si precipita il magnesio come idrossido Mg(OH)2 a un valore di pH maggiore di 10 e poi si effettua una titolazione con EDTA, usando un opportuno indicatore. Il primo indicatore metallocromico usato è la muresside che a pH 12 dà, con il calcio, un colore rosa che al punto finale della titolazione vira al blu-viola.
A questo valore di pH precipita l’idrossido di magnesio che non inficia la titolazione. Tuttavia con la muresside il viraggio è meno netto rispetto ad altri indicatori come, ad esempio, la metalftaleina che a pH 11 dà con il calcio un colore rosso e pertanto al punto finale vira in modo molto netto da rosso a incolore.
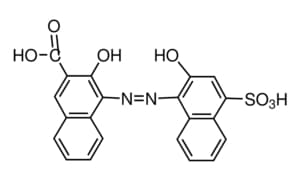
L’indicatore di gran lunga preferito per la determinazione del calcio in presenza di magnesio è l’acido calconcarbossilico, comunemente chiamato indicatore di Patton e Reeder che è un colorante azoico, strutturalmente simile al nero eriocromo T che capacità di fornire un punto finale anche in presenza di magnesio
L’acido calconcarbossilico libero è di colore blu, ma vira al rosa/rosso quando forma un complesso con gli ioni calcio. L’EDTA, tuttavia, forma un complesso più stabile con il calcio rispetto a quello che forma con l’acido calconcarbossilico, quindi l’aggiunta di EDTA al complesso acido Ca-calconcarbossilico provoca la formazione di Ca-EDTA, portando al ritorno al colore blu dell’acido calconcarbossilico libero.

Questo metodo di titolazione complessometrica dipende dal fatto che il pH della soluzione sia sufficientemente alto da garantire che gli ioni magnesio precipitino e pertanto viene solitamente aggiunto alla soluzione idrossido di sodio concentrato o idrossido di potassio.
Per calcolare la concentrazione del calcio si può usare la formula:
Ca2+ (g/mL) = mLEDTA · MEDTA · MMCaCO3 · 100/mLCamp
Per la determinazione del magnesio, una volta calcolata la durezza dell’acqua e aver fatto la determinazione del calcio se nella titolazione per la determinazione della durezza e per la determinazione del calcio si usa lo stesso volume di campione si può usare la seguente formula:
Mg2+ (g/mL) = (mLEDTA-dur – mLEDTA-Ca) · MEDTA- · MMMg · 100/mLCamp
dove mLEDTA-dur è il volume di EDTA usato per la determinazione della durezza data dagli ioni calcio e magnesio, mLEDTA-Ca è il volume di EDTA usato per la determinazione del calcio, MEDTA è la molarità dell’ acido etilendiamminotetracetico, MMMg è il peso atomico del magnesio pari a 24.3050 u mLCamp è il volume del campione di acqua analizzata.



